1.02 – SISTEMI ETEROGENEI E SISTEMI OMOGENEI
La materia si può presentare in 2 forme: miscela o sostanza pura.
MISCELE O MISCUGLI:
Una miscela è composta da due o più sostanze che possono essere separate mediante tecniche fisiche. Non presentano caratteristiche ben definite. A seconda del modo in cui le sostanze si mescolano, le miscele o i miscugli si dividono in:
Miscele eterogenee:
Una miscela è eterogenea se è costituita da due o più fasi e i suoi componenti sono facilmente distinguibili. Una miscela eterogenea prende il nome di miscuglio. Ogni componente della miscela eterogenea si chiama fase. Si riconoscono le sostanze ad occhio nudo oppure con il microscopio. A seconda delle fasi che si trovano si distinguono in:
- Aerosol = è una miscela eterogenea costruita da una fase solida o liquida dispersa in una fase gassosa (Es.: nebbia)
- Emulsione = miscela di 2 fasi liquide disperse una nell’altra (Es.: olio e aceto)
- Sospensione = è un sistema costituito da una fase solida dispersa in una fase liquida e le particelle possono essere viste con un microscopio ottico (Es.: sale nell’olio)
- Colloidi o dispersioni colloidali: Sono miscele costituite da particelle solide o liquide con diametro compreso tra 5 e 200 nanometri (nm). Sono sistemi con caratteristiche intermedie tra quelle delle soluzioni e quelle dei miscugli eterogenei o sospensioni grossolane. Sono considerati pseudosoluzioni perché a prima vista appaiono come miscugli omogenei. Possono essere considerati sistemi bifasici perché, in certe condizioni, si riesce a distinguere le 2 fasi
Sono stabili grazie al moto browniano chiamato così dallo scienziato Robert Brown il primo che lo osservò -> Es.: pigmenti utilizzati per le vernici
Un modo per distinguere una soluzione da un colloide è quello di farli attraversare da un raggio di luce: nel caso della soluzione il raggio passa senza traccia invece nel caso del colloide il raggio viene percepito perché viene disperso in tutte le direzioni dalle particelle sospese (effetto Tyndall). Es.: olio, acqua, rocce, sangue e latte
Miscele omogenee o soluzioni:
Sono molecole uguali che si mescolano tra di loro in modo uniforme. Hanno le proprietà chimico-fisiche uguali in ogni punto quindi sono formate da una sola fase. Non si riconoscono le varie sostanze neanche con il microscopio. Sono costruiti da un componente presente in maggior quantità chiamato solvente e un componente presente in minor quantità chiamato soluto. Possono esistere in tutti e 3 gli stati di aggregazione della materia. (Es.: sale, acqua, l’acqua di mare, il vino e l’aria)
COSE SEPARO LE MISCELE O MISCUGLI?
Le miscele o miscugli vengono separati mediante specifici METODI DI SEPARAZIONE:
- Se separo una miscela dai suoi componenti con metodi fisici si ottengono sostanze pure
- Se devo separare una miscela eterogenea uso i mezzi meccanici (Es.: filtrazione)
- Se devo separare una miscela omogenea o una soluzione uso i passaggi di stato (Es.: distillazione) o uso la cromatografia
I metodi di separazione più usati sono:
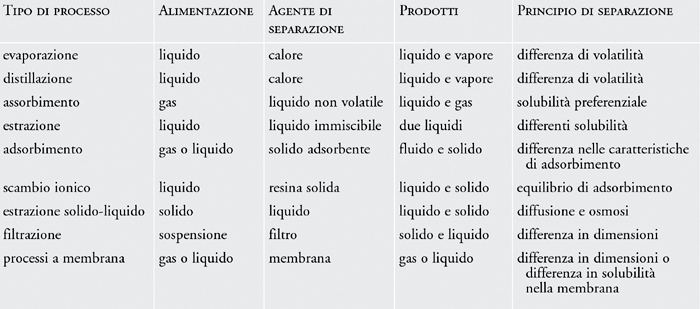
- Filtrazione: È uno dei metodi più usati. Permette di separare i componenti di una miscela eterogenea costituita da un liquido e da un solido sfruttando la diversa dimensione delle particelle. Si usano dei filtri
- Distillazione: permette di separare i componenti di una miscela sfruttando la diversa temperatura di ebollizione. È un processo che rappresenta una trasformazione fisica e comporta dei passaggi di stato. Può essere:
Semplice: quando si separa un liquido da una soluzione solido-liquido
Frazionata: quando si separa un liquido da una soluzione di 2 o più liquidi
- Cromatografia: permette di separare i componenti della miscela sfruttando la diversa velocità con cui questi migrano attraverso un materiale di supporto (chiamato fase fissa, ha la funzione di far aderire i componenti del miscuglio in base alla loro natura ed un esempio è: la carta) sotto la spinta di solvente (si chiama eluente o fase mobile, trasporta i componenti del miscuglio attraverso un materiale). Ideata da Mikhail Tswett nel 1906
- Centrifugazione: permette di separare rapidamente i componenti della miscela grazie alla loro differenza di densità sfruttando la forza centrifuga (= è una forza che viene percepita da un osservatore fisso in un sistema di riferimento che si sta muovendo con moto accelerato o con moto circolare)
- Estrazione con solventi: sfrutta la solubilità di una sola delle sostanze della miscela in un determinato solvente. Si impiega un solvente di estrazione
- Evaporazione: per separare il solvente dai soluti disciolti cioè separa i componenti di una soluzione
SOSTANZE O SOSTANZE PURE:
Sono i materiali che hanno una composizione uniforme, costante e definita (Es.: acqua distillata). È formata da una sola specie chimica -> cioè da una sola sostanza . Le loro caratteristiche restano costanti in qualsiasi parte della Terra. In realtà in natura le sostanze pure non esistono perché qualsiasi sostanza contiene sempre piccole percentuali di impurezze. È formata da un solo tipo di unità fondamentale, che può essere:
- Un atomo (Es.: gas nobile)
- Una molecola
La cella elementare di un reticolo cristallino tridimensionale (Es.: composti ionici)
In base alla possibilità di scindere una sostanza in componenti più semplici o di non riuscirla a scindere si distinguono in 2 sostanze:
- Composti = possono essere scissi con metodi chimici in 2 o più sostanze più semplici, perché formati da atomi di diverso tipo legati tra loro per formare reticoli cristallini tridimensionali (Es.: cloruro di solido, acqua e ammoniaca)
- Elementi o sostanze elementari o sostanze semplici = non possono essere scomposti in sostanze più semplici, perché formati da atomi uguali (Es.: Fe, Au e O2)
Esercizio 1
Nel seguente elenco il candidato indichi quale può essere considerata sostanza pura
1- acqua di mare
2- sale
3- acqua rubinetto
4- aria
- A solo 1
- B solo 2
- C solo 3
- D solo 4
- E tutte
Correzione commentata
La risposta corretta è la lettera B poiché il sale è l’unica sostanza pura dell’elenco. L’acqua di mare è è una soluzione (cioè un miscuglio omogeneo) di acqua, sali e ossigeno disciolti; l’acqua del rubinetto è è un miscuglio omogeneo, perché è formato da acqua più sali minerali, quali calcio, iodio, potassio; l’aria è un miscuglio di gas e di microscopiche particelle solide e liquide.
Esercizio 2
Il candidato scarti l’alternativa errata
- A elementi e composti mescolati insieme formano miscugli
- B la centrifugazione separa lentamente i componenti della miscela
- C la filtrazione sfrutta la diversa dimensione delle particelle
- D La cromatografia separa i componenti della miscela sfruttando la diversa velocità con cui migrano attraverso un materiale di supporto.
- E La distillazione sfrutta la temperatura di ebollizione
Correzione commentata
La risposta da scartare è la lettera B poiché la centrifugazione permette di separare rapidamente i componenti della miscela grazie alla loro differenza di densità sfruttando la forza centrifuga.