10.03 – Gli idrocarburi: benzene
Gli Idrocarburi sono composti organici formati prevalentemente da atomi di idrogeno e atomi di carbonio. Gli atomi di carbonio (C) sono legati tra loro a formare lo scheletro della molecola, mentre gli idrogeni (H) sporgono da questo scheletro. Gli idrocarburi sono l’unica categoria di composti organici privi del gruppo funzionale (per gruppo funzionale si intende una parte specifica della struttura di una molecola che conferisce al composto una reattività tipica e simile a quella di altri composti contenenti lo stesso gruppo. Per esempio, il gruppo (-OH) identifica la parte funzionale degli alcoli. In pratica, tutte le molecole che contengono un gruppo (-OH) hanno un comportamento chimico-fisico similare). Gli idrocarburi si possono suddividere in diversi modi. Sono composti molecolari apolari, insolubili in H20, sono solubili nei solventi organici apolari (tra cui etere e benzene) e sono meno densi nell’H2O. Non esistono interazioni dipolo-dipolo, legami a idrogeno. Le uniche interazioni intermolecolari possibili sono le forze Van der Waals. Hanno un basso punto di fusione ed ebollizione e all’aumentare del numero degli atomi di carbonio, aumentano le interazioni di Van der Waals I valori del punto di fusione e del punto di ebollizione aumentano all’aumentare degli atomi di carbonio presenti nella molecola. Sono i composti più semplici dei composti organici. In base al loro stato fisico nelle condizioni di pressione e di temperatura ambientali si distinguono:
• idrocarburi solidi o semisolidi (per esempio l’asfalto e il bitume);
• idrocarburi liquidi, come i costituenti del petrolio (benzene, esano, ottano ecc.);
• idrocarburi gassosi, quali metano, etano, propano, butano ecc.
Dal punto di vista delle proprietà chimiche, gli idrocarburi si distinguono in due grandi gruppi a loro volta suddivisi in sottogruppi:
- idrocarburi alifatici: con atomi di carbonio legati a formare catene lineari, ramificate (aciclici) oad anelli (aliciclici); questi possono essere ulteriormente suddivisi in saturi e insaturi a seconda chesiano presenti o meno uno o più legami multipli;
- idrocarburi aromatici: dotati di “aromaticità”, una proprietà chimica derivata da un anello benzenico, che li rende particolarmente stabili.

AROMATICI:
Sono particolari idrocarburi insaturi a catena chiusa. Il termine “aromatico”, inizialmente attribuito per il particolare odore di alcuni, raggruppa tutti i composti che possiedono proprietà chimiche simili a quelle del benzene. La loro formazione avviene nel corso di combustioni incomplete di combustibili fossili, legname, grassi, tabacco, incenso e prodotti organici in generale, quali i rifiuti urbani. Trovano impiego nella produzione di coloranti, plastiche, pesticidi e medicinali. Contengono anelli carboniosi con legami a elettroni delocalizzati. Sono idrocarburi monocicli insaturi. Si dividono in:
- Monociclici -> BENZENE
- Polociclici
Benzene:
Friedrich August Kekulé fu il primo studioso a proporre nel 1865 la formula di struttura del benzene. Ha formula bruta C6H6, con i sei atomi di carbonio disposti ai vertici di un esagono regolare planare. Ogni atomo di carbonio ha ibridazione sp2, quindi forma tre legami σ, due con i carboni adia- centi e il terzo con un atomi di idrogeno.
Gli altri sei orbitali 2p disponibili (uno per ogni carbonio, con un elettrone spaiato), invece di unirsi a due a due per formare tre doppi legami alternati a tre legami singoli, si fondono tutti e sei, originando due nubi elettroniche, una sopra e l’altra sotto il piano determinato dalla catena di atomi di carbonio. In questo modo i 6 elettroni π non si trovano localizzati su coppie specifiche di carboni, ma sono di- stribuiti in modo omogeneo (o delocalizzati) su tutto l’anello, rendendo la molecola particolarmente stabile.

È un composto ciclo a 6 atomi di carbonio in cui c’è l’alternanza di legami semplici e legami doppi che si realizza con una delocalizzazione degli elettroni di legame p su tutta la molecola. Si chiama delocalizzazione elettronica. È contenuta nella teoria degli orbitali molecolari in cui dice che:
“La molecola reale è una sola e i suoi 6 elettroni p sono delocalizzati su tutta la molecola”
I 6 orbitali p si combinano a formare 6 orbitali molecolari (3 sono di legami e 3 sono di antilegame (= è un tipo di legame chimico dato dalla sovrapposizione di 2 orbitali molecolari semipieni)) e questo dà più stabilità alla molecola. Si rappresenta con un cerchio all’interno dell’esagono e non si mettono gli atomi di H. Grazie a questa delocalizzazione la molecola è stabile. È rappresentato, secondo la teoria della risonanza, come un ibrido di risonanza tra 2 forme limite che differenziano solo per la posizione dei doppi legami.
Sono numerosissimi i composti aromatici che si possono considerare derivati dal benzene.
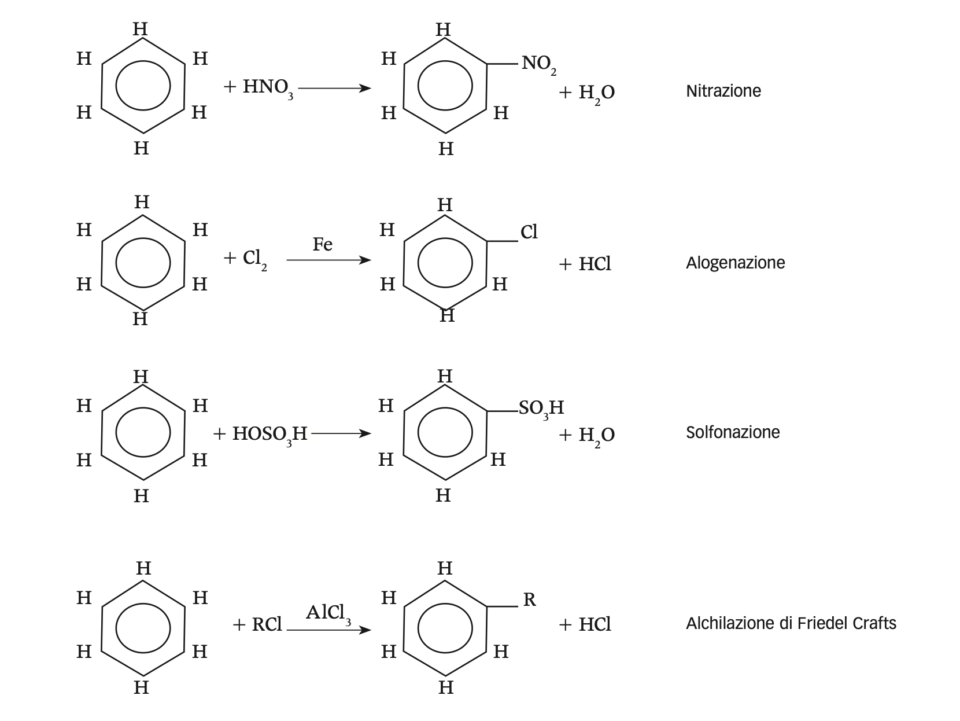
In linea teorica essi si ottengono per sostituzione di uno o più H+ dell’anello con altri radicali chimici. Ecco alcuni esempi di reazioni di sostituzione possibili.
- Nitrazione dà come risultato la sostituzione di un atomo di idrogeno con un gruppo NO2
- Alogenazione porta alla sostituzione di un atomo di idrogeno del benzene con un atomo di Cl
- Solfonazione
- Alchilazione di Friedel Crafts
Regole di nomenclatura
Per la nomenclatura dei derivati aromatici è molto diffuso l’uso dei nomi comuni; nel caso in cui i sostituenti sono due si utilizzano spesso, in sostituzione della numerazione, le diciture orto, meta e para a seconda che rispettivamente i due gruppi siano su carboni adiacenti, separati da un carbonio o frontali. Quando i sostituenti sono più di due è necessario ricorrere alla numerazione, seguendo le regole valide per gli idrocarburi alifatici (numerazione più bassa, ordine alfabetico ecc.).
Un composto è aromatico ciclico se:
Se sotto e sopra il piano della molecola è presente una nuvola ciclica di elettroni p delocalizzati. Deve contenere 4n + 2 elettroni p (n = 1,2,3, ecc…). Questa infatti è la regola di Hückel, la quale permette di capire in meno di 1 secondo se un idrocarburo è aromatico. Come? Si contano gli elettroni che si trovano nell’orbitale p, e se combaciano con la regola 4n+2 (dove “n” è un numero intero, es: n=1,2,3,…), allora significa che il composto è aromatico.
Sono composti apolari, insolubili in H20, solubili nei solventi organici apolari più comuni. Sono inoltre solventi di sostanze poco polari e apolari (Es.: iodio)e sono meno densi dell’H20
Il punto di fusione e il punto di ebollizione aumentano all’aumentare del numero di atomi di carbonio della molecola. A temperatura ambiente il benzene è liquido. I derivati policiclici, a temperatura ambiente, sono solidi
È un centro ricco di elettroni che si comporta come reagente neutrofilo (= base di Lewis) e reagisce con i reagenti elettrofili (= acidi di Lewis)
Derivati del benzene:
È il precursore degli idrocarburi aromatici. È derivato da una sostituzione di uno o più atomi di idrogeno con radicali alchilici o gruppi funzionali. Se il sostituente è un gruppo alifatico si ottengono gli areni
Per la nomenclatura dei derivati monosostituiti si utilizzano nomi comuni
Quando ci sono 2 sostituenti, bisogna indicare la posizione nell’anello e se si può fare in 2 modi:
- Indica la posizione dei sostituenti numerando gli atomi di C dell’anello da partire di uno di quelli che ha il sostituente
- Indica la posizione del secondo sostituente rispetto al primo con i prefissi -orto (quando ho sostituenti in posizione 1, 2), meta- (quando ho sostituenti in posizione 1, 3) e para- (quando ho sostituenti in posizione 1, 4)
Per i derivati polisostituiti la posizione dei sostituenti si indica mediante la numerazione degli atomi di carbonio nell’anello; in modo che tutti i sostituenti hanno il numero più basso possibile. I derivati del benzene sono i composti policiclici formati da 2 o più anelli benzenici condensati o concatenati.
Idrocarburi policiclici
Sono gli idrocarburi formati dall’unione di più anelli benzenici, spesso chiamati IPA (Idrocarburi aro- matici policiclici). In questi composti alcuni atomi di carbonio sono condivisi da più anelli aromatici. Ricordiamo a titolo d’esempio il benzopirene, sostanza cancerogena presente nel fumo di sigaretta e che si può sviluppare anche nelle cotture alla griglia non ben eseguite.