10.04 – Gli idrocarburi: Alcani e alcheni
ALIFATICI:
A seconda dei tipi di legame C-C presenti nella molecola (singolo, doppio o triplo) e della loro geometria (lineare, ramificata, ciclica), gli idrocarburi alifatici si dividono in:
• idrocarburi saturi, con soli legami singoli C-C, come gli alcani e i cicloalcani.
• idrocarburi insaturi, che contengono almeno un legame C-C multiplo (cioè doppio o triplo), quali gli alcheni, i dieni, i cicloalcheni, gli alchini, i cicloalchini.
Gli alcani sono idrocarburi saturi (nella molecola non ci sono doppi legami) a catena aperta. Hanno formula generale CnH2n+2, cioè il numero degli atomi di idrogeno presenti nella molecola è uguale al doppio del numero degli atomi di carbonio, aumentato di 2 (per esempio, il propano è costituito da 3 atomi di carbonio legati con 3 × 2 + 2 = 8 atomi di idrogeno).Il nome degli alcani termina con la desinenza “-ano”. Il metano è l’alcano più semplice (formula bruta: CH4), con il carbonio posto al centro di un tetraedro. L’etano, con formula bruta C2H6 e formula di struttura e il propano ha formula CH3–CH2–CH3.

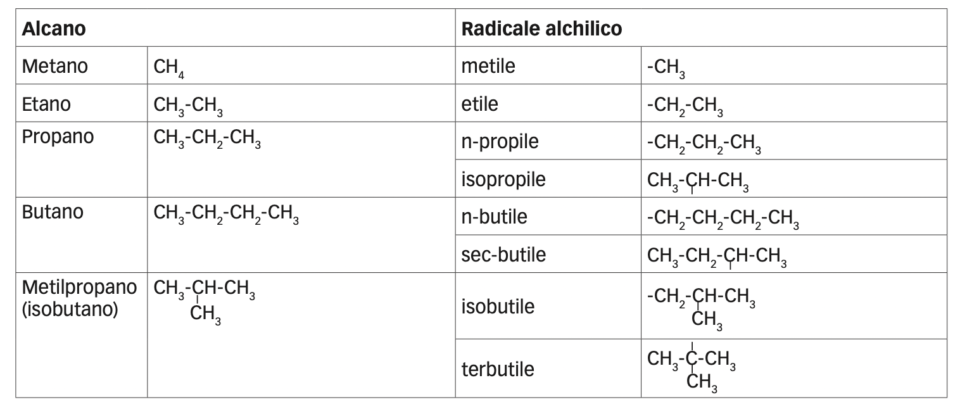
Se da una molecola di un alcano si toglie un atomo di idrogeno, si ha un radicale R, che prende il nome dall’alcano di partenza sostituendo alla desinenza “-ano” il suffisso “-ile”. Questi radicali al- chilici possono sostituire un idrogeno e quindi agganciarsi alla catena carboniosa principale, dando origine a strutture ramificate.
Regole di nomenclatura
Secondo la IUPAC (International Union of Pure and Applied Chemistry) le regole principali per la no- menclatura degli alcani sono le seguenti:
1. Scegliere come struttura base la catena più lunga possibile e darle il nome dell’alcano lineare
corrispondente, il cui nome è formato da una radice (indicante il numero di atomi di carbonio della catena principale) e la desinenza “-ano”; i primi quattro prefissi sono: met-, et-, prop-, but- (quindi metano, etano, propano e butano), gli altri seguono la numerazione greca (pentano, esano ecc.); se sono presenti più catene “principali” con lo stesso numero di atomi di carbonio, la priorità appartiene a quella con il maggior numero di ramificazioni.
- Numerare gli atomi di carbonio della catena principale partendo dall’estremità più vicina ai sosti- tuenti e individuare il nome di ognuno.
- Se ci sono due ramificazioni equidistanti dalle estremità della catena principale, la numerazione comincia dall’estremità vicina al sostituente primo in ordine alfabetico (per esempio 3-etil-5-metil e non 5-etil-3-metil); se è presente una terza ramificazione oltre alle precedenti, la numerazione deve iniziare dall’estremità più vicina alla terza ramificazione (per esempio, se partendo da sini- stra avessimo 2,3,6-trimetil, mentre da destra 2,5,6-trimetil dobbiamo optare per la prima nume- razione).
- Scrivere il nome dell’alcano disponendo prima tutti i sostituenti in ordine alfabetico, senza consi- derare il prefisso (ciascuno preceduto dal numero del carbonio al quale è legato), quindi aggiunge- re il nome della catena principale (per esempio 2-cloro-3-metilesano).
- Se un sostituente compare più di una volta come catena laterale, si aggiunge il prefisso di-, tri-, te- tra- ecc. al nome del sostituente, preceduto dai numeri corrispondenti al carbonio a cui sono legati (per esempio 2,3-dimetilpentano).
- Tra numero e parola va messo un trattino, mentre tra i numeri va posta una virgola.
I primi 4 alcani sono gas, gli alcani fino al 15 sono liquidi e dal 16 in poi sono solidi
Il punto di ebollizione degli alcani e cicloalcani cresce all’aumentare della massa molecolare
Gli alcani lineari hanno punti di ebollizione superiori rispetto agli alcani ramificati
Gli alcani ramificati hanno punti di fusione più elevanti rispetto agli alcani lineari
Sono composti apolari e sono buoni solventi nelle sostanze apolari
Sono insolubili in H20 perché con essa non possono formare né legami a idrogeno né legami dipolo-dipolo
Hanno una densità minore dell’H20 quindi gli alcani galleggiano sull’H20
Ha una geometria tetraedrica con angolo di legame di 109,5°
Conformazione: è ciascuna delle possibili forme che può assumere la molecola
Hanno orbitali molecolari
Es.: CH3 – CH2 – CH2 – CH3 (butano)
Gli alcani reagiscono con l’ossigeno per dare reazioni di combustione con cui ricaviamo l’energia necessaria a ricoprire la maggior parte del nostro fabbisogno energetico; per questo motivo, gli idrocarburi liquidi e gassosi sono utilizzati come combustibili
Gli alcani si chiamano anche paraffine (= poco reattivi) sono caratterizzati da una bassissima reattività chimica perché i legami C-C e C-H sono forti e poco polarizzati per la scarsa differenza di elettronegatività tra idrogeno e carbonio. Infatti tutte le reazioni degli alcani avvengono in condizioni drastiche cioè o con un catalizzatore o con il calore e sono aspecifiche. Quindi le principali reazioni sono:
Alogenazione:
È una reazione di sostituzione in cui uno più atomi di H vengono sostituiti da atomi di alogeno (Cl, Br o F)
Le reazioni in cui un atomo o un gruppo di atomi sostituisce un altro atomo si chiamano reazioni di sostituzione
Prodotti: alogenuro alchilico (formula generale R-X in cui R = gruppo alchilico e X = alogeno) + l’acido alogenidrico corrispondente
Questa reazione richiede energia che può essere fornita con il calore o con le radiazioni UV
Come prodotti spesso ci sono miscele di alogenati (Es.: CH4 + n Cl2 -> i prodotti possono essere CH3Cl, CH2Cl2, CHCl3, CCl4 + n HCl)
Radicali = è una specie con un elettrone spaiato; per questo motivo la reazione di alogenazione degli alcani si chiama sostituzione radicalica
Combustione:
È una reazione di ossidazione in cui l’idrocarburo (= combustibile) reagisce con l’ossigeno (= comburente) e come prodotti ho CO2 + H20
È molto esotermica ma a temperatura ambiente non avviene e deve essere innescata perché ha una alta energia di attivazione
Se avviene senza ossigeno come prodotti otteniamo CO2, CO (è altamente tossico) e altri composti di ossidazione parziale
Deidrogenazione:
Con questa reazione vengono eliminate le molecole di idrogeno e i prodotti sono dei composti insaturi (alcheni e alchini)
Es.: CH3-CH3 (etano) -> H2 + CH2 = CH2 (etene)
Cracking:
È una reazione di frammentazione di una catena idrocarburica lunga in frammenti più piccoli che avviene ad alta temperatura e in presenza di catalizzatori
Produce una miscela di prodotti derivati dalla fermentazione della molecola di partenza in diversi punti
Questo processo viene utilizzato per i residui della distillazione frazionata del petrolio
Per assegnare il nome ha un idrocarburo ramificato dobbiamo individuare la catena di atomi di carbonio più lunga poi bisogna individuare le sue ramificazioni (ciascuna ramificazione è un radicale alchilico (cioè un gruppo di atomi derivato da un alcano per allontanamento di un atomo di idrogeno, si indica con R-); il loro nome si ottiene sostituendo la desinenza -ano con -ile) (Es.: CH3 – CH2 –> è un etile)
Per disegnare la formula di struttura a partire dal nome di un composto organico, è necessario seguire queste regole:
1- Scrivere tanti atomi di carbonio quanti sono quelli indicati dalla lunghezza della catena principale
2- Numerarla e scrivere i vari radicali nelle posizioni indicate dai numeri corrispondenti
3- Completare la formula di struttura riportando gli atomi di idrogeno legati ad ogni atomo di carbonio della catena principale, ricordando che ogni carbonio deve dare 4 legami
Per distinguere i gruppi alchilici, è utile classificare gli atomi di carbonio in:
Primari -> sono legati a un atomo di carbonio
Secondari -> sono legati a 2 atomi di carbonio
Terziari -> sono legati a 3 atomi di carbonio
Quaternari -> sono legati a 4 atomi di carbonio
Se dal proprano e dal butano si allontana un idrogeno legato al carbonio secondario si ottengono il radicale sec-propile o isopropile e il sec-butile. Il radiacale che viene dopo ha 4 atomi di carbonio però ha un carbionio terziario per questo si chiama ter-butile.
Gli alcani presentano 3 isomerie:
Isomeria conformazionale -> C’è una rotazione intorno ai legami C – C. Quando i legami tra gli atomi sono semplici, ognuno di questi è libero di assumere nello spazio una qualsiasi posizione rispetto agli altri. Così gli alcani possono presentare forme spaziali diverse, per esempio nel caso dell’etano si può avere la forma eclissata (quando gli idrogeni di un carbonio “eclissano” quelli dell’altro, se la molecola viene osservata frontalmente) o la forma sfalsata (quando gli idrogeni dei due carboni assumono la disposizione spaziale più lontana l’uno dall’altro):
Isomeria di struttura -> la catena può essere lineare o ramificata, aperta o chiusa o a ciclo
Isomeria ottica -> se la molecola contiene almeno un carbonio chirale
Il numero di isomeri strutturali aumenta col crescere del numero di atomi di carbonio della molecola
La catena può essere:
- Aperta -> lineare o ramificata
- Chiusa a formare un anello -> Es: idrocarburi ciclici
I più semplici idrocarburi ciclici o idrocarburi aliciclici o alifatici ciclici sono i cicloalcani:
Sono derivati dagli alcani a catena aperta per eliminazione di 2 atomi di idrogeno (uno per ciascuno dei 2 atomi di carbonio che devono unirsi tra loro) da 2 carboni non congiunti e una successiva saldatura dei 2 atomi di carbonio a esso legati
A partire dal propano, è possibile chiudere la catena di atomi di C e così si formano i cicloalcani
I cicloalcani sono idrocarburi a catena chiusa con formula CnH2n e con ibridazione sp3. Il più semplice è il ciclopropano formato da tre atomi di carbonio, segue il ciclobutano, il ciclopentano e il cicloesano, rappresentati rispettivamente con il triangolo equilatero, il quadrato, il pentagono e l’esagono. A ogni vertice delle figure corrisponde un gruppo CH2.
Il nome dei radicali alchilici derivati dai cicloalcani ha la desinenza -ile. La struttura non è planare (tranne nel ciclopropano) e non è rigida infatti l’anello può fluttuare nello spazio senza rompersi. Presentano proprietà chimico-fisiche uguali a quelle degli alcani a catena aperta. I primi 2 sono gassosi, i 5 seguenti sono liquidi e dal ciclodecano in poi sono solidi Il nome si ottiene mettendo prima del nome dell’alcano a catena aperta corrispondente il prefisso -ciclo (Es.: ciclopropano)
Possono essere rappresentati con poligoni regolari, ciascun vertice del poligono è un gruppo CH2.
Regole di nomenclatura
1. Il nome del cicloalcano deriva dall’alcano corrispondente a cui si antepone la parola “ciclo”.
2. I sostituenti sulla catena vengono numerati in modo che abbiano la numerazione più bassa possibile e vengono elencati in ordine alfabetico (indipendentemente dal numero corrispondente).
3. Se è presente un solo sostituente non serve numerazione (per esempio metilcicloesano).
4. Se sono presenti due sostituenti, a quello per primo in ordine alfabetico va dato il numero 1 (per esempio 1-etil-2-metilciclobutano e non 1-metil-2-etilciclobutano).
Si individuano 2 diverse disposizioni degli atomi di idrogeno:
- Disposizione assiale: cioè parallela all’asse della molecola
- Disposizione equatoriale: cioè gli atomi di idrogeno sono disposti a raggio intorno al perimetro della molecola
Presentano 3 isomerie:
Isomeria geometrica: Se due carboni attigui sono legati ognuno a gruppi diversi, questi possono trovarsi in posizione reciproca diversa, originando due molecole di pari formula molecolare e stessa struttura, ma con diversa disposizione spaziale dei legami. Per la loro struttura ciclica è impossibile interconversione da una forma all’altra se non con la rottura del legame. Se i gruppi più voluminosi si trovano dallo stesso lato rispetto al piano della molecola l’isomero viene indicato cis o Z, se da parte opposta trans o E. Questi isomeri presentano caratteristiche fisiche diverse.
Isomeria conformazionale. Il ciclopropano non ha isomeria conformazionale, la sua molecola è plana- re; il ciclobutano ha una struttura leggermente ripiegata, con angolo di legame di 88°, ben lontano dal valore previsto dal tipo di ibridazione presente (sp3 e angolo di legame 109,5°), tant’è che la compressione che si viene a generare rende la molecola instabile. Gli altri cicloalcani non sono planari e quindi possono presentare isomeria conformazionale. Quello più studiato è il cicloesano, che può assumere una particolare conformazione a sedia (la più stabile) o a barca.
A sedia: più stabile perché gli atomi di idrogeno sono meno ravvicinati nello spazio (6 atomi di idrogeno con disposizione assiale e 6 atomi di idrogeno con diposizione equatoriale, questo fa diminuire le forze repulsive tra le nuvole elettroniche perché gli idrogeni sono alternati)
A barca: meno stabile
Isomeria cis-trans
Isomeria ottica
- Insaturi -> tra cui:
- ALCHENI
- ALCHINI
ALCHENI
Sono insaturi perché presentano uno o più legami doppi C = C (formati da un legame σ e un legame p che impedisce la libera rotazione dei gruppi legati intorno al doppio legame C – C e quindi irrigidisce la struttura) con ibridazione sp2 quindi hanno 3 orbitali ibridi sp2 e un orbitale p puro. Hanno formula CnH2n (con n ≥ 2). Hanno la stessa formula grezza dei cicloalcani quindi un cicloalcano e il corrispondente alchene sono isomeri. Ha una geometria triangolare planare con angolo di legame circa di 120°; grazie alla geometria planare le posizioni delle molecole dell’alchene sono “quasi” fisse perché c’è il legame p che NON FA ruotare gli atomi di carbonio insaturi intorno al doppio legame. Hanno orbitali molecolari che sono 1 sigma + 1 pigreco. Il doppio legame è il gruppo funzionale degli alcheni e il rende più reattivi però la fragilità del legame p rende disponibili 2 elettroni p che vengono utilizzati per legare un reagente elettrofilo
Si dividono in:
- Polieni o alcheni polifunzionali -> contengono uno o più doppi legami e si dividono in 2 gruppi:
- Dieni:
Formula generale CnH2n-2. Contengono 2 doppi legami nella molecola e in base alla loro posizione i 2 doppi legami possono essere:
- Cumulati o alleni: adianti lungo la catena
- Isolati: separati da più di un legame semplice
- Coniugati: separati da un solo legame semplice, presentano il fenomeno della risonanza quindi per ogni composto si possono scrivere tante forme limite di risonanza questo accade perché gli elettroni p dei doppi legami coniugati sono delocalizzati e il fenomeno rende la molecola più stabile
- Trieni -> Formula generale: CnH2n-4
Es.: CH3 – CH = CH – CH3 (2-butene)
Nomenclatura: si numera la catena più lunga dall’estremità più vicina al doppio legame; la posizione del doppio legame si indica prima del nome del numero dell’atomo di carbonio sul quale inizia il doppio legame
La nomenclatura IUPAC ha le seguenti regole per attribuire il nome dell’alchene:
1- Individuare la catena di atomi di carbonio più lunga
2- Numerarla in modo da attribuire il numero più basso possibile ai doppi
3- Scrivere il nome dei radicali in ordine alfabetico
4- Nominare la catena principale indicando il numero di atomi di carbonio e mettendo la desinenza -ene; il nome va preceduto dal numero più basso del carbonio tra i 2 atomi coinvolti nel legame doppio
5- Nel caso in cui sia presente più di un doppio legame o di un triplo legame, indicare i numeri dei carboni coinvolti e usare il prefisso di-, tri-, tetra-, … davanti a -ene. In questo caso, rimane la a di -ano
6- Se sono presenti sia un doppio sia un triplo legame, si scrivono il numero del doppio legame, la lunghezza della catena, il suffisso -en (cade la e finale per attaccare il resto del nome), il numero del carbonio del triplo legame e il suffisso -ino
Es.: 2,3-dietil-1,4-pentadiene
Se l’idrocarburo è ramificato, è necessario individuare la catena più lunga
La numerazione deve partire dall’atomo di carbonio più vicino al doppio legame. Il nome di una ramificazione in cui compare un doppio legame o un triplo legame termina in -enil o -inil. L’idrocarburo più semplice è l’etene o etilene -> CH2 = CH2
Presentano 3 isomerie:
- Isomeria di struttura
- Isomeria di posizione
- Isomeria cis-trans:
Se i 2 gruppi atomici diversi o 2 atomi diversi si trovano nella stessa posizione rispetto al doppio legame, l’isomero è cis
Se i 2 gruppi atomici diversi o i 2 atomi diversi sono situati da parti opposte rispetto al doppio legame l’isomero è trans. Punto di fusione: fonde SEMPRE a una temperatura più alta rispetto il cis. Polarità: è apolare rispetto al cis
Questi 2 isomeri (= gli isomeri cis-trans) sono stereoisomeri cioè differiscono SOLO per la disposizione degli atomi nello spazio
Gli isomeri cis e trans differiscono per il punto di fusione, per il punto di ebollizione e per la polarità
La reazione caratteristica è la reazione di addizione del doppio legame e si chiama addizione elettrofila:
I reagenti si chiamano elettrofili (= sono molecole o ioni che possono accettare un doppietto elettronico. Es.: H+ e tutti gli acidi forti)
Il prodotto che si ottiene è un carbocatione (si forma dopo la rottura di un legame quando il doppietto elettronico che all’inizio è condiviso poi uno dei 2 atomi acquista il doppietto elettronico, sono molto reattivi e si combinano con i nucleofili (sono anioni e molecole con doppietti elettronici disponibili))
Si sviluppa in 2 stadi:
Formazione del carbocatione
Il carbocatione è attaccato dal nucleofilo
Prendono i nomi diversi in base al tipo di reagente addizionato quindi possiamo avere:
Idrogenazione
Alogenazione (catalizzatore: HOCl)
Idratazione (catalizzatore: H2SO4)
Addizione di acidi alogenidrici (catalizzatore: HCl)
Idrogenazione: alchene + H -> alchini + idrocarburi saturi (ci deve essere l’idrogeno gassoso; catalizzatore: palatino o palladino)
Polimerizzazione:
Un polimero è una grossa molecola organica con alto peso molecolare, costituita dalla ripetizione di un numero alto di unità più semplici (chiamate monomeri)
Sono disponibili divere tecniche per ottenere polimeri artificiali; in base al metodo di preparazione si distinguono in 2 tipi di polimeri:
Polimeri di addizione: si ottiene tramite una serie di reazioni di addizione a catena (= poliaddizione), ciascuna è attivata da una particella reattiva (= è un radicale libero, un anione o un catione); prodotto: una particella reattiva simile a quella che fa partire la reazione
Polimeri di condensazione: ottenuti tramite una reazione tra 2 gruppi funzionali diversi di 2 monomeri bifunzionali con eliminazione di una molecola piccola
I polimeri possono essere:
Lineari -> se le catene sono costituite solo da unità bifunzionali (Es.: lana, seta ecc..)
Ramificati o reticolati -> se le catene contengono unità tri- o polifunzionali (Es.: amido)
In base al tipo di monomero si distinguono in:
Omopolimeri -> formati da monomeri uguali
Copolimeri o eteropolimeri:
Formati da monomeri diversi
Si distinguono in:
Alternati -> quando i monomeri si ripetono secondo una sequenza regolare
Irregolari -> se si monomeri si alternano secondo una sequenza casuale
Alcheni e alchini sono ottime materie prime per la sintesi di polimeri attraverso le reazioni di polimerizzazione con questa reazione R- CH2CH2 + NCH2 = CH2 -> R – (CH2CH2)n – CH2CH2
I polimeri possono essere:
Naturali -> Es.: amido, glicogeno, cellulosa, proteine, acidi nucleici e cacciù
Artificiali -> non esistono in natura e sono stati inventati dall’uomo. Il PE e PVC derivati dalla polimerizzazione degli alcheni. (Es.: polietilene (PE), polivinilcloruro (PVC), polistirene o polistirolo, polipropilene, polifluoroetilene o Teflon e neoporopene)