10.08 – Derivati degli idrocarburi: Eteri, Aldeidi e chetoni, Acidi carbossilici e derivati
ETERI:
- Formula generale: R-O-R’ cioè contengono un atomo di ossigeno e lega 2 gruppi achilici o arilici
- Sono derivati da acqua per sostituzione di 2 atomi di idrogeno con 2 gruppi alchilici o arilici -> che possono essere:
- Uguali -> si chiamano eteri simmetrici o semplici (Es.: CH3 – CH2 – O – CH3)
- Diversi -> si chiamano eteri asimmetrici o misti (Es.: CH3 – O – CH2 – CH3)
- Angolo di legame: 110°
- Nomenclatura: il nome si ottiene dalla parola etere preceduta o seguita dal nome dei 2 radicali, messi in ordine alfabetico (Es.: CH3 – CH2 – O – CH2 – CH3 -> si chiama etere dietilico o dietiletere). Alcuni eteri ciclici hanno spesso nomi di fantasia
- Non formano legami a idrogeno intermolecolari ma formano legami idrogeno tra alcoli e fenoli
- Hanno punti di ebollizione inferiori a quelli degli alcoli però sono superiori rispetto a quelli degli idrocarburi e a quelli degli eteri
- Sono ottimi solventi di molte sostanze organiche
- Gli eteri a basso PM sono liquidi, molto volatili e infiammabili
- Il legame etero è molto forte e può essere scisso solo con acidi forti e con il calore
- Si ottengono con una reazione di condensazione tra 2 alcoli (si chiama disidratazione) -> è un’unione di 2 molecole con l’eliminazione di acqua
ALDEIDI e CHETONI:
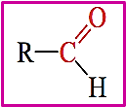
- Formula generale aldeidi:
- Formula generale chetoni:
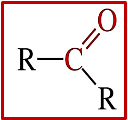
- Il gruppo C ═ O si chiama gruppo carbonilico o carbonile, è un gruppo fortemente polarizzato, nelle aldeidi è alla fine della catena, nei chetoni è in posizione interna e il carbonio del gruppo carbonilico è ibridato sp2 con angoli di legame 120°
- Gruppo funzionale chetoni: R-CO-R’
- Gruppo funzionale aldeidi: R-CHO
- Desinenza delle aldeidi: –ale
- Desinenza dei chetoni: –one
- Nomenclatura delle aldeidi: il nome deriva dall’idrocarburo sostituendo la lettera finale con la desinenza –ale; la catena va numerata a partire dall’estremità più vicina al carbonio carbonilico cioè il carbonio 1. Le aldeidi aromatiche di uso commerciale vengono spesso chiamate con i nomi tradizionali. Il gruppo -CHO è legato ad un anello si aggiunge il prefisso –carbaldeide (Es.: CH3-CHO)
- Nomenclatura dei chetoni: il nome deriva dall’idrocarburo sostituendo la lettera finale con la desinenza -one; la catena va numerata dall’estremità più vicino al carbonio carbonilico. Sono utilizzati i nomi d’uso o nomi comuni. Per i chetoni semplici il nome si ottiene con la parola chetone prima del nome dei 2 radicali legati al gruppo carbonilico (Es.: CH3-CO-CH3 -> propanone o acetone e CH2 ═ CH–C ═ O-CH3 -> 3-buten-2-one)
- Sono composti polari
- Le aldeidi e chetoni a basso peso molecolare sono molto solubili in acqua
- Non possono formare legami a idrogeno intermolecolari
- Hanno punti di fusione e di ebollizione più alti degli idrocarburi a ugual numero di atomi di carbonio e con massa molecolare equivalente, ma sono più bassi degli alcoli
- Aldeidi e chetoni bollono a temperature inferiori rispetto ai corrispondenti alcoli
- Possono formare legami a idrogeno con acqua
- Il legame C-O è polarizzato
- Tra molecole di aldeidi e chetoni si formano legami dipolo-dipolo intensi
- Le aldeidi e i chetoni fino a 5 atomi in carbonio sono idrosolubili, mentre le aldeidi e i chetoni superiori a 5 atomi di carbonio sono solubili nei solventi organici
- Grazie alla presenza dell’atomo di ossigeno, il gruppo carbonilico è tanto polarizzato e quindi è molto reattivo
- La reazione tipica è la reazione di addizione nucleofila e avviene in seguito all’attacco da parte di una base di Lewis (è un gruppo nucleofilo che in grado di cedere in doppietto elettronico) sul carbonio del gruppo carbonilico (è formato da C=O e si comporta da elettrofilo perché ha una parziale carica positiva)
- Una reazione di particolare importanza nucleofila avviene quando il gruppo -CHO reagisce con -OH (funge da nucleofilo) e il prodotto che si forma si chiama emiacetale
- L’addizione di idrogeno o riduzione di un’aldeide da come prodotto un alcol primario
- L’addizione di idrogeno o la riduzione di un chetone da come prodotto un alcol secondario
- Le aldeidi si ossidano facilmente e come prodotto danno gli acidi carbossilici
- I chetoni possono essere ossidati solo da ossidati forti che rompono la catena a livello del gruppo carbonilico e come prodotti danno ossidanti a catena più corta
- La formaldeide o aldeide formica o metanale:
- È l’aldeide più semplice
- Nel commercio è una soluzione acquosa al 37% e viene chiamata formalina
- Viene utilizzata come disinfettante, come conservante e come materia prima per la produzione di materie plastiche
- Si prepara in industria con l’ossidazione del metanolo
- L’acetone o propanone (CH3-CO-CH3):
- È il chetone più semplice
- Viene utilizzato come solvente perché è in grado di scogliere molto sostanze organiche, vernici, smalti per unghie, resine e coloranti
- Si prepara in industria con l’ossidazione dell’alcol isopropilico
- Sono molti diffusi in natura e molti hanno odori gradevoli (Es.: l’aldeide cinnamica si trova nella cannella)
ACIDI CARBOSSILICI:
- Formula generale: RCOOH
- Gruppo funzionale: -COOH -> è un gruppo carbossilico, formato da un gruppo carbonilico (C=O, il carbonio è ibridato sp2) e da un gruppo ossidrile (-OH)
- Desinenza: -oico
- Nomenclatura:
- Il nome si ottiene dal nome dell’alcano corrispondente, mettendo prima la parola acido e sostituendo la lettera finale con la desinenza -oico
- La numerazione della catena inizia dal carbonio del gruppo carbossilico
- Sono molto utilizzati i nomi d’uso o nomi comuni o nomi correnti: derivano dal nome della fonte originale e quando si usano la posizione dei sostituenti viene specificata indicando gli atomi di carbonio della catena con le lettere greche α, β e γ iniziando dal carbonio numero 2
ACIDI CARBOSSILICI PIÙ IMPORTANTI:
- L’acido formico o acido metanoico
- contenuto nelle secrezioni di alcuni insetti (Es.: api e formiche rosse) e alcune piante (Es.: ortiche). È un liquido caustico di odore pungente, ha proprietà antisettiche e germicide, si usa nell’industria della gomma ed è utilizzato come conservante e come mordente in tintoria
- l’acido acetico o acido etanoico:
- Acido etanoico è il nome IUPAC dell’acido acetico
- È contenuto nell’aceto, come prodotto della fermentazione fatta a partire dall’etanolo e da batteri Acetobacter
- È l’acido carbossilico più importante
- Viene utilizzato come materia prima in numerose sintesi industriali
- È molto diffuso in natura come intermedio di tante reazioni biochimiche
- È un ottimo solvente per composti organici e inorganici
- Viene come regolatore di acidità nell’industria lamentare
- È impiegato come reagente nella produzione delle colle da legno (Es.: acetato di polivinile) e di molte fibre sintetiche
- L’acido citrico:
- È un acido tricarbossilico abbondante in tutti gli agrumi
- È un additivo alimentare
- Si ottiene con la fermentazione di sostanze zuccherine
- È utilizzato nell’industria alimentare e in quella farmaceutica
- Si utilizza per la tintura e per la stampa dei tessuti
- È contenuto nella frutta
- Acido propanico o acido propionico
- è in additivo alimentare ed è usato come conservante nel pane, nelle paste alimentari fresche e nelle patatine
- Acido butanico o acido butirrico
- è contenuto nel burro acido, in alcuni formaggi, nel burro e nei grassi di origine animale
- Acido sorbico
- è un additivo alimentare, inibisce funghi e muffe e viene addizionato ai formaggi
- Acido benzoico
- è un additivo alimentare è impiegato come antimicrobico nelle bevande alcoliche e nella pasticcieria
- Acido etanoico o acido ossalico
- è un acido bicarbossilico, è utilizzato nell’industria tessile ed è utilizzato per rimuovere le macchie
- Acido butandioico o acido succinico
- si trova nella lattuga e in altri prodotti vegetali
- Acido tereftalico
- è utilizzato nell’industria delle fibre sintetiche e per la produzione del PET per le bottiglie in plastica
- Acido lattico
- è un idrossiacido, è un additivo alimentare ed è utilizzato come conservante nelle olive
- Acido tartarico
- è un additivo alimentare, fa parte della formazione di caramelle, bevande analcoliche e lieviti chimici e si trova nella frutta e nel vino
- Acido salicilico
- è utilizzato per produrre l’asprina e il salicilato di metile (= è un estere del metanolo)
- Sono molecole polari
- Possono formare legami a idrogeno intermolecolari con H20 e i legami portano all’unione di 2 molecole dell’acido
- Gli acidi carbossilici fino a 4 atomi di carbonio sono solubili in acqua, poi la solubilità diminuisce fino ad annullarsi all’aumentare del numero di atomi di carbonio nella catena
- Hanno punti di fusione e di ebollizione abbastanza elevati (sono più alti dei punti di fusione e di ebollizione degli alcoli e degli idrocarburi)
- Gli acidi carbossilici fino a 8 atomi di carbonio con PM basso sono liquidi, incolore e di odore pungente
- Gli acidi carbossilici superiori a 8 atomi di carbonio sono inodori e a basso punto di fusione
- Sono acidi deboli che si dissociano così: RCOOH + H2O ⇄ RCOO– + H3O+; questa dissociazione è favorita da 2 cause:
- Effetto elettron-attrattore (= è costituito da un atomo o da un gruppo di atomi che attraggono densità di carica elettronica da atomi vicini. Se il gruppo è presente in una catena attrae a sé elettroni inducendo una parziale carica positiva (questa carica si propaga sugli atomi presenti nella catena) sull’atomo in cui è legato questo gruppo, in questo caso l’ossigeno) dell’ossigeno del gruppo C = O che indebolisce il legame ossigeno – idrogeno
- Stabilizzazione della risonanza per lo ione carbossilato
- Già che sono acidi deboli, reagiscono con le basi forti e formano dei sali degli acidi grassi chiamati saponi
- Dagli acidi carbossilici si ottengono dei derivati degli acidi:
- Come struttura hanno il gruppo arilico (R-C =O), poi hanno altri gruppi
- La reazione di sostituzione nucleofila acilica accomuna gli acidi carbossilici e i derivati degli acidi ed è formata da 2 stadi
- Si possono ottenere per ossidazione delle aldeidi
- Se faccio reagisce un acido con un ossidante blando ottengo come prodotto un’aldeide
- Se faccio reagire l’acido con un ossidante forte ottengo come prodotto l’alcol primario
- Si possono trasformare in esteri quando il carbonio del gruppo C =O è attaccato al nucleofilo R-OH
Acidi grassi:
- Sono presenti sotto forma di gliceridi di acidi grassi animali e vegetali per questo vengono chiamati acidi grassi
- Sono acidi carbossilici con una lunga catena idrocarburica lineare
- Contiene più di 8 atomi di carbonio
- Può essere:
- Satura
- gli acidi grassi saturi sono:
- Acido laurico
- Acido miristico
- Acido palmitico
- Acido stearico
- Insatura
- gli acidi grassi insaturi sono:
- Acido palmitoleico
- Acido oleico
- è il costituente degli ioni vegetali ed è contenuto nell’olio d’oliva
- Acido linoleico
- Acido linolenico
- Satura
ESTERI:
- Formula generale:
- Sono derivati dagli acidi per sostituzione del gruppo -OH con un gruppo -OR (si chiama gruppo alcossidico)
- Nomenclatura: il nome si ricava dal nome dell’acido sostituendo la desinenza –ico o -oico con la desinenza -ato, seguito dal nome del radicale R’ del gruppo carbossilico
- Si ottengono quando un acido carbossilico e un alcol sono riscaldati e insieme producono estere + acqua e la reazione si chiama esterificazione -> è catalizzata dagli ioni H+, è una reazione di equilibrio ed è una reazione è reversibile: la reazione inversa è l’idrolisi -> cioè idrolizzo un estere e ottengono l’acido e l’alcol di partenza
- Gli esteri a basso peso molecolare sono di odore gradevole, grazie a loro abbiamo il particolare odore della frutta e il profumo dei fiori
- Esteri naturali di elevato peso molecolare sono:
- Le cere -> sono esteri provenienti da un alcol con un solo gruppo -OH a catena lunga e un acido carbossilico a catena lunga (Es.: CH3(CH2)14-COO-(CH2)15CH3 -> palmitato di cetile)
- I grassi e gli oli:
- Possono essere solidi o liquidi a temperatura ambiente
- Si formano dalla reazione tra glicerolo e acidi grassi insaturi
- Sono triesteri insaturi del glicerolo e per questo sono chiamati trigliceridi
ANIDRIDI:
- Formula generale:
- Nomenclatura: il nome deriva dal nome dell’acido corrispondente sostituendo la parola acido con la parola anidride
- Si preparano per condensazione tra acidi carbossilici -> questa reazione è reversibile cioè idrolizzando le anidridi ottengono come prodotto gli acidi di partenza
AMMINE
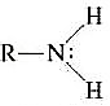
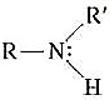
- Sono derivati da NH3 per sostituzione dei suoi atomi di idrogeno con uno, due o tre gruppi R o Ar
- Si classificano in:
- Ammina primaria
- Ammina secondaria
- Ammina terziaria
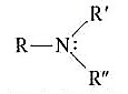
- La sua struttura è di tipo piramidale
- Gruppo caratteristico: gruppo amminico
- Nomenclatura: si indicano i gruppi organici legati all’azoto e si aggiunge la desinenza -ammina. Se i gruppi organici legati all’azoto sono uguali si aggiunge i prefissi di- o tri-. Per le ammine aromatiche usiamo i nomi comuni
- La ammina più importante è la anilina -> preparata in industria per la riduzione del nitrobenzene e utilizzata per la preparazione di vernici, coloranti e smalti
- La serotonina e la morfina sono ammine e hanno un’importanza biologica
- Sono molecole polari
- Le ammine secondarie e primarie formano legami a idrogeno con sé stesse e con acqua però questo legame è meno forte del legame degli alcoli perché l’azoto è meno elettronegativo dell’ossigeno
- Hanno punti di fusione e di ebollizione più alti di quelli degli alcani corrispondenti ma inferiori a quelli degli alcoli corrispondenti
- Sono solubili in acqua quando la catena carboniosa non supera i 5 atomi di
- Sono basi più deboli degli idrossidi alcalini ma più forti dell’acqua
- Il doppietto elettronico libero presente sull’azoto spiega le proprietà basiche delle ammine cioè possono acquistare ioni H+ da acqua, secondo questa reazione:
- Le ammine con una base forte (Es.: HCl) possono fare una protonazione dell’azoto completa e come prodotto otteniamo un sale solubile
AMMIDI:
- Formula generale: R-CO-NH2.
- Desinenza: -ammide
- Sono derivati dagli acidi per sostituzione del gruppo -OH di un acido carbossilico con un gruppo -NH2 (= gruppo amminico, è l’ammina primaria) o -NHR (ammina secondaria) o –NR2 (ammina terziaria)
- Nomenclatura: il nome si ricava sostituendo il suffisso -ico o -oico dell’acido carbossilico con la desinenza -ammide
- Si ottengono da una reazione di condensazione tra un acido carbossilico o un etere o un’anidride e l’ammoniaca o una ammina primaria o una ammaina secondaria; secondo questa reazione: Cloruro acilico + 2NH3 -> Ammide + NH4Cl. Questa reazione è reversibile quindi se le ammidi vengono idrolizzante in ambiente basico o acido come prodotti otteniamo l’acido carbossilico e l’ammoniaca o ione ammonio
- Hanno punti di fusione e di ebollizione elevati
- Formano forti legami idrogeno tra le molecole
- 2 ammidi importanti sono:
- La nicotinammide o vitamina PP
- Derivati dell’acido barbiturico -> utilizzati come sedativi e nel controllo dell’epilessia
Nitrili o cianuri:
- Formula generale: R – C ≡ N
- Sono derivati dall’acido cianidrico per sostituzione dell’atomo di idrogeno con gruppo alchilico o arilico
- Gruppo funzionale: -C ≡ N -> si chiama gruppo cianuro o nitrile
- Desinenza: -nitrile