2.01 – L’atomo
L’atomo è un elemento o una minima frazione di materia che conserva le caratteristiche chimiche ma non quelle fisiche di un elemento (es. H, un elemento è una sostanza pura che non può essere trasformata in sostanze ancora più semplici e sono costituiti da atomi che hanno le stesse proprietà chimiche)
La parola atomo deriva da atomos che significa indivisibile ed è la più piccola parte di materia non divisibile
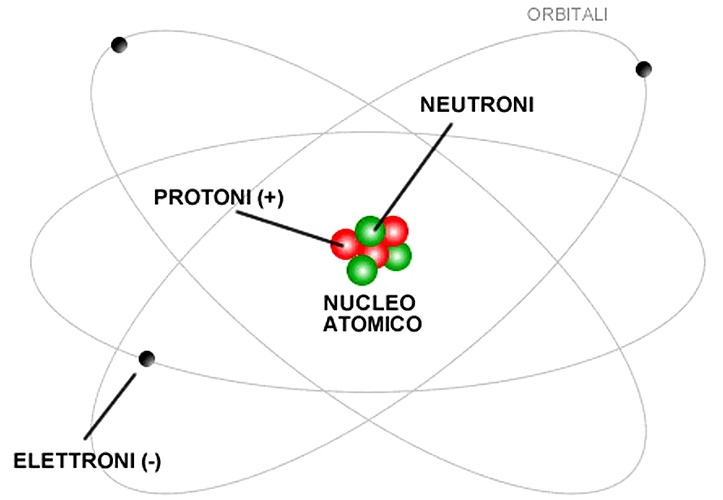
L’atomo è costituito da un nucleo con protoni (+) e neutroni, circondato da elettroni (-)
- Protone: carica = + 1,6 x 10-19 C; massa = 1,67 x 10-27 kg ossia 1 UMA (= unità di massa atomica). I protoni e i neutroni sono costruiti da quark (= è una particella fondamentale che fa parte della materia)
- Neutrone: carica = 0; massa = 1 UMA = protone
- Elettrone: carica = – 1,6 x 10-19 C; massa = piccolissima
LE SCOPERTE CHE SONO STATE FATTE PER ARRIVARE ALL’ATOMO?
TEORIE ATOMICHE:
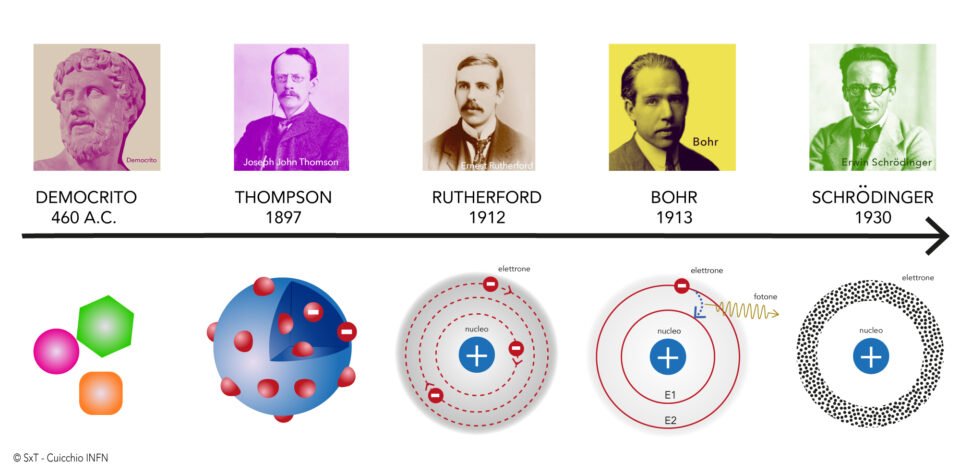
Già nel 400 d.C. Democrito propone una teoria atomica non scientifica secondo la quale l’atomo costutiva l’elemento fondamentale dell’universo. La prima teoria atomica è quella di Dalton (1802)
Per confermare l’esistenza dell’atomo saranno fondamentali 2 leggi:
- La legge di conservazione della massa di Lavoisier (1783) secondo cui in una reazione chimica le somme delle masse dei reagenti è uguale alle somme delle masse dei prodotti
- La legge delle proporzioni definite di Proust (1799) secondo cui in una sostanza pura gli elementi hanno un rapporto peso definito e costante
La TEORIA ATOMICA DI DALTON (1802) è la prima teoria atomica. Secondo Dalton gli elementi sono fatti di piccole particelle che sono chiamate atomi (in un elemento gli atomi sono tutti uguali). Nelle reazioni chimiche gli atomi conservano la propria identità. Un composto è costituito da atomi di elementi diversi. In un particolare composto, la massa dell’atomo e il tipo di atomi di ogni elemento sono costanti. A Dalton dobbiamo la Legge delle proporzioni multiple (1803)la quale stabilisce che quando due elementi si combinano per formare due o più composti, tenendo fissa la quantità di uno, le quantità dell’altro stanno tra loro in rapporti esprimibili con numeri piccoli e interi.
- Es.: CO + CO2
- C -> massa atomica: 12 g
- O -> massa atomica: 16 g
- CO2 -> 12 (C) + 16 (O) + 16 (O)
- Massa di O = [16 + 16 (In CO2) ] / 16 (In CO) = 32/16 = 2
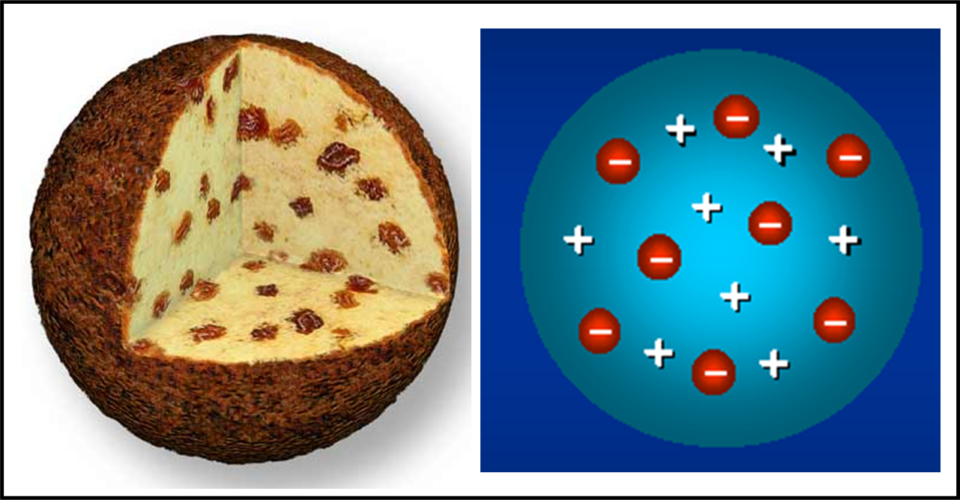
Segue il MODELLO A PANETTONE DI THOMSON
Il modello atomico di Thomson, detto anche modello atomico a panettone, è un’ipotesi sulla struttura dell’atomo proposta da Joseph John Thomson nel 1904, prima della scoperta del nucleo atomico.
Secondo Thomson, in in base ai dati allora disponibili, gli elettroni (di carica negativa) fossero dispersi come uvetta in un panettone (da qui il nome di “modello atomico a panettone“) in una massa elettricamente positiva, in modo da determinarne l’equilibrio delle cariche. Dunque l’atomo ha una massa positiva e all’interno ha una massa negativa (ossia gli elettroni)
Piuttosto, le perplessità erano legate ai palesi problemi su stabilità ed instabilità che ha il modello, e dunque l’inspiegabilità della radioattività, senza ricorrere ancora all’esistenza di altri tipi di forze oltre a quella elettromagnetica e gravitazionale.
Segue il MODELLO PLANETARIO DI RUTHERFORD (1911)
Crediti foto: “I lincei”-
Il modello atomico di Rutherford detto modello planetario fu pubblicato nel 1911 a seguito degli studi del chimico e fisico neozelandese naturalizzato britannico, premio Nobel per la Chimica nel 1908 e pioniere della fisica nucleare. Le ricerche di Rutherford andavano in una direzione diversa da quelle di Thomson. Secondo Rutherford infatti la massa positiva è nel nucleo e quelle negative orbitano intorno in orbite circolari al nucleo. Nell’atomo dunque c’è spazio vuoto.
A partire dalla sua descrizione, si prese a rappresentare l’atomo con il nucleo al centro e gli elettroni in orbita attorno ad esso, come i pianeti del sistema solare attorno al Sole. A causa di questa particolare rappresentazione divenne noto come modello planetario.
Secondo Rutherford l’elettrone circola su un’orbita circolare ma per le leggi dell’elettromagnetismo l’elettrone dovrebbe emettere delle radiazioni. Emettendo radiazioni l’elettrone perde energia e dunque, non avendo energia, doveva venir attirato dai protoni del nucleo fin quando non collassava nel nucleo MA QUESTO NON ACCADE!!
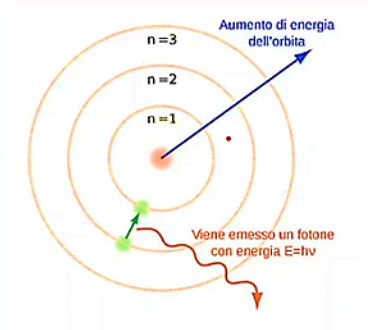
Infine segue il MODELLO DI BOHR O IDROGENO (1913)
Grazie al fisico danes Bohr viene superato quello che è il limite della fisica classica. Egli decise di applicare al modello atomico di Rutherford la teoria quantistica propria del fisico Max Planck proposta nel 1900.
Secondo Bohr solo alcune orbite circolari sono permesse: l’elettrone quindi può circolare su determinate orbite (n = 1; n = 2) cioè può muoversi sui numeri quantici principali (che indicano quanta energia ha l’elettrone)
L’elettrone circola solo su determinate orbite in quanto l’energia dell’elettrone è quantizzata.
Il modello atomico di Bohr presentò presto tutti i suoi limiti: non era applicabile ad atomi con molti elettroni e non spiegava gli spettri atomici in presenza di un campo magnetico. Le contraddizioni emerse in questo modello erano dovute all’inadeguatezza delle leggi della meccanica classica.
Oggi si rappresenta l’atomo con un nucleo che contiene i protoni (particelle cariche positiva- mente) e i neutroni (particelle prive di carica), e con elettroni (particelle di carica negativa) che girano intorno al nucleo secondo tutte le direzioni dello spazio. La teoria attuale nasce dalla meccanica quantistica e il ruolo di primo piano viene ricoperto dalle teorie di fisici come:
- De Broglie dice che l’atomo può essere considerato sia come un’onda sia come una particella (dualismo onda-particella) e Bohr lo considera solo come un atomo
- Heisenberg formula il principio di indeterminazione secondo cui non si può conoscere la posizione e la velocità dell’elettrone e dunque cade il concetto di orbita
- Schrodinger che grazie ai suoi studi introdusse il concetto di orbitale definendolo come la regione attorno al nucleo di un atomo in cui vi è un’elevata probabilità di trovare un elettrone.
Il fisico tedesco Heisenberg studiò il modello atomico di Bohr riscontrando limiti soprattutto riguardanti il concetto di orbita. Bohr affermava che gli elettroni si muovessero attorno al nucleo su delle orbite, presupponendo di conoscere velocità e posizione degli elettroni in ogni momento. Heisenberg dimostrò che era impossibile determinare con precisione arbitraria la velocità e posizione contemporaneamente.
Il Principio di indeterminazione di Heisenberg afferma infatti che non è possibile misurare simultaneamente e con precisione le proprietà (ossia la velocità e la posizione) di una piccola particella elementare. Conseguenza di tale principio è che per gli elettroni non si può parlare di traiettorie ma di spazi dove la probabilità di trovare un elettrone è diversa da zero.
Per questi motivi si passa dal concetto di orbita (intesa come il tragitto che compie l’elettrone che non si potrà mai conoscere) ad ORBITALE (intesa come la porzione di spazio in cui è altamente possibile trovare l’elettrone)
Esercizio 1
Quale delle seguenti affermazioni è sbagliata ?
1- secondo Lavoiser le somme delle masse dei reagenti è uguale alla metà delle masse dei prodotti
2- due elementi si combinano per formare due o più composti, tenendo fissa la quantità di uno, le quantità dell’altro stanno tra loro in rapporti esprimibili con numeri piccoli e interi
3- l’atomo presenta un nucleo al centro e gli elettroni girano attorno ad esso su delle orbite
- A solo 1
- B solo 2
- C solo 3
- D solo 1 e 2
- E solo 1 e 3
Correzione commentata
La risposta corretta è la lettera D in quanto
1- la legge di conservazione della massa di Lavoisier afferma che in una reazione chimica le somme delle masse dei reagenti è uguale alle somme delle masse dei prodotti
2- Il Principio di indeterminazione di Heisenberg afferma infatti che non è possibile misurare simultaneamente e con precisione le proprietà (ossia la velocità e la posizione) di una piccola particella elementare. Conseguenza di tale principio è che per gli elettroni non si può parlare di traiettorie ma di spazi dove la probabilità di trovare un elettrone è diversa da zero.Per questi motivi si passa dal concetto di orbita (il tragitto che compie l’elettrone che non si potrà mai conoscere) ad ORBITALE (la porzione di spazio in cui è altamente possibile trovare l’elettrone)
Esercizio 2
Cosa dice il principio di indeterminazione di Heisenberg?
1- non è possibile misurare simultaneamente velocità e posizione di una particella
2- non è possibile misurare simultaneamente intensità e forza (relative alla velocità) di una particella
3- l’atomo può essere considerato sia come onda che come particella
- A solo 1
- B solo 2
- C solo 3
- D solo 1 e 2
- E solo 2 e 3
Correzione commentata
La risposta corretta è la lettera A poiché Il Principio di indeterminazione di Heisenberg afferma infatti che non è possibile misurare simultaneamente e con precisione le proprietà (ossia la velocità e la posizione) di una piccola particella elementare. Non si parla dunque di intensità e forza. L’affermazione 3 è falsa perché è la teoria dualismo onda particella (non Principio di indeterminazione di Heisenberg )