2.02 – NUMERO DI MASSA O ATOMICO
Tutti gli atomi dello stesso elemento hanno lo stesso numero di protoni nel nucleo. L’idrogeno è l’elemento più semplice, con un solo protone nel nucleo. Il numero di protoni in un elemento rappresenta il numero atomico, il cui simbolo è Z. Le masse delle particelle atomiche fondamentali sono spesso espresse in unità di massa atomica (u). Un’unità di massa atomica, 1u, è un dodicesimo della massa di un atomo di carbonio con sei protoni e sei neutroni (1 atomo di carbonio= massa di 12 u). Poiché i protoni e i neuroni hanno una massa molto vicina a 1u e l’elettrone invece ha una massa che è solo 1/2000 di questo valore, conoscendo il numero di protoni e neutroni si può stimare la massa approssimata di un atomo. Tale somma viene chiamata numero di massa ed è indicata con il simbolo A.
Nella tavola periodica gli elementi sono classificati a seconda di Z, numero atomico in ordine crescente.
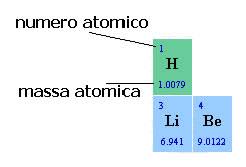
Il numero atomico (Z) è ciò che distingue un elemento da un altro.
Solo in pochi casi tutti gli atomi di un campione di un certo elemento presente in natura hanno la stessa massa. La maggior parte degli elemento è formata da atomi con diversi numeri di massa. Per esempio esistono due tipi di atomi di boro: uno con massa 10u, l’altro con massa 11u.
Gli atomi con lo stesso numero atomico Z, ma con differente numero di massa A, sono chiamati isotopi. Tutti gli atomi di un elemento hanno lo stesso numero di protoni. Dunque per avere numero di massa diverso presentano un diverso numero di neutroni. Si fa riferimento a un particolare isotopo indicando il suo numero di massa (es. uranio-238), ma gli isotopi dell’idrogeno sono così importanti che possiedono nomi e simboli specifici. Tutti gli atomi dell’idrogeno hanno un solo protone; quando questa è l’unica particella nel nucleo, l’isotopo è chiamato prozio oppure idrogeno. L’idrogeno isotopo con un neutrone
21 H è chiamato deuterio o idrogeno pesante (simbolo D). Il nucleo dell’isotopo radioattivo idrogeno -3 è chiamato trizio 31 H.
- PROZIO (11H) : neutroni = 0
- DEUTERIO (2 1 H) (D) : neutroni = 1; neutroni + protoni = 2
- TRIZIO (31H) : neutroni = 2; neutroni + protoni = 3
Parlando di abbondanza percentuale indichiamo il rapporto tra il numero di atomi di un dato isotopo e il numero totale degli atomi di tutti gli isotopi di quell’elemento (il tutto moltiplicato per 100%). Gli isotopi di un elemento sono separabili con lo spettrometro di massa. Questo strumento misura le masse degli isotopi e le loro abbondanze percentuali.
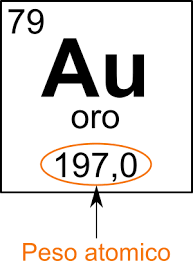
Il peso atomico (o massa atomica) dell’elemento è la massa atomica di un atomo è la massa di quel singolo atomo espressa in unità di massa: grammi o kilogrammi. Il peso atomico relativo indica quante volte la massa di un atomo è maggiore (ovvero più “pesante”) rispetto all’unità di massa atomica.
Alcune definizioni:
Unità di massa atomica (si misura in uma o Dalton) = è la quantità di materia pari a ½ della massa di un isotopo 12 del carbonio (12C) con una massa pari a 12 e vale 1,66 x 10-27 kg
Massa atomica (MA) = è il rapporto fra la massa assoluta dell’atomo e l’unità di massa atomica e la sua unità di misura è grammi
Il peso atomico (PA) è dato dalla media ponderata di tutti gli isotopi del C, la sua unità di misura è u.m.a. o dalton e la formula è PROTONI + NEUTRONI
Massa molecolare relativa o peso molecolare (MM o PM) = è uguale alla somma delle masse atomiche degli atomi che costituiscono la molecola, ognuna moltiplicata per il suo indice
MASSA MOLARE (M) = è uguale alla massa atomica o massa molare o peso formula. Espressa in gmol e varia da sostanza a sostanza
Peso formula (PF) = si utilizza con composti ionici ed è la somma dei pesi atomici degli atomi che compaiono nella formula minima, ognuno moltiplicato per il suo indice
L’Angstrom è l’unità di misura della dimensione atomica
La massa atomica relativa (mr) è il rapporto tra la massa dell’atomo in esame e la dodicesima parte della massa dell’isotopo 12 del carbonio. Nei composti ionici si usa il concetto di massa formula per indicare la massa molecolare relativa

Esercizio 1
Quale tra le seguenti affermazioni è falsa ?
1- il numero atomico e di massa sono rispettivamente numero di protoni e somma di protoni e neutroni
2- il numero atomico distingue un atomo da un altro
3- gli isotopi sono atomi con lo stesso numero di massa Z ma diverso numero atomico
- A solo 1
- B solo 2
- C solo 3
- D solo 1 e 2
- E solo 2 e 3
Correzione commentata
La risposta corretta è la lettera C. Gli isotopi sono atomi con lo stesso numero atomico Z, ma con differente numero di massa A.
Esercizio 2
cosa hanno in comune Azoto-15 e Carbonio-14 ?
- A neutroni
- B protoni
- C elettroni
- D nucleoni
- E nessuna delle precedenti
Correzione commentata
La risposta corretta è la lettera A. Il carbonio-14 presenta 6 protoni e dunque per arrivare a 14(numero di massa, somma di neutroni e protoni) facciamo una sottrazione->14-6=8 neutroni. L’azoto 15 presenta 7 protoni e facendo 15-7= 8 neutroni.