2.03 – NUMERI QUANTICI E ORBITALI
La teoria di Bohr sul modello dell’atomo di idrogeno ( 1913 ) ha dato un contributo importante alla conoscenza del comportamento degli atomi, tuttavia, la sua teoria non è in grado di dare una descrizione completa del comportamento degli elettroni ed è stato evidente, fin dalla sua formulazione che dovevano esistere dei fattori supplementari.
Nel 1926 Erwin Schrödinger elaborò un’ equazione che descrive il comportamento e l’energia di particelle sub-atomiche in generale; un’equazione analoga alle leggi del moto di Newton della Fisica classica.
L’ equazione di Schrödinger riesce a prevedere sia il comportamento corpuscolare in termini della massa m della particella, sia il comportamento ondulatorio, in termini di una funzione d’onda ψ , che descrive la posizione del sistema nello spazio ( ad es. la posizione di un elettrone in un atomo ).
La funzione d’onda,non ha un significato fisico diretto,ma il suo quadrato è proporzionale alla probabilità di trovare la particella in una certa regione nello spazio.
In pratica, il posto più probabile dove trovare una particella è quello in cui il valore della funzione d’onda è massimo.
Una conseguenza di questo principio è che nel caso di un elettrone orbitante in un atomo non si può parlare di traiettoria ma di regione dello spazio in cui la probabilità di trovare l’elettrone è diversa da zero.
TEORIA DI SCHROEDINGER
L’orbitale è descritto da un’equazione d’onda o da una funzione d’onda (ψ). L’equazione d’onda è descritta dai numeri quantici: n, l ed m
- Tipi di orbitali di forma diversa:
- S: sferico
- P: bilobato simmetrico
- D
- F
N = NUMERO QUANTICO PRINCIPALE
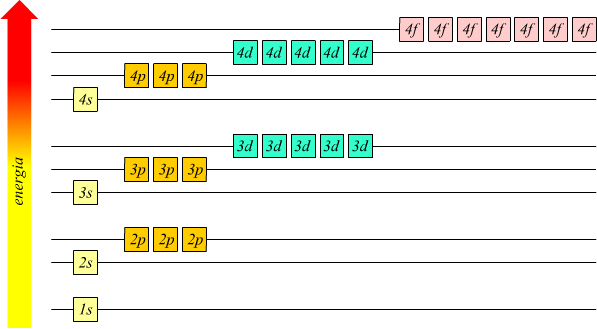
E’ l’energia (cioè il livello energetico) di un elettrone e dimensione dell’orbitale. Individua le dimensioni dell’orbitale. Più grande è n, maggiore è la distanza dal nucleo. n=1,2,3…7 esso corrisponde al numero quantico del modello di Bohr; in quella teoria n determinava automaticamente il contenuto energetico dell’orbita ma questa regola non è più valida per un atomo ‘multielettronico’.
L = NUMERO QUANTICO SECONDARIO o ANGOLARE
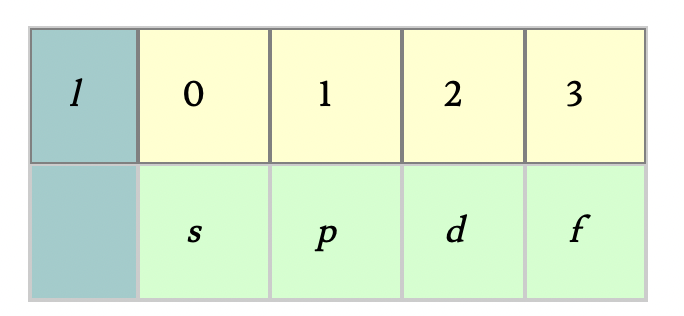
Descrive la forma degli orbitali atomici. I valori di l sono interi e dipendono dal valore del numero quantico principale n. Ad ogni valore di l viene associata una delle lettere s, p, d ed f.
- l = 0 -> orbitale s (cioè sferico)
- l = 1 -> orbitale p (cioè bilobato simmetrico)
- l = 2 -> orbitale d
- l = 3 -> orbitale f
vale da 0 a n-1
M = NUMERO QUANTICO MAGNETICO
Descrive l’orientamento degli orbitali nello spazio. All’interno di un sottolivello il valore di m dipende dal valore di l. Per un certo valore di l ci sono 2l+1 valori interi di m.
Ci sono:
- 1 orbitale s
- 3 orbitali p
- 5 orbitali d
- 7 orbitali f
Il numero dei valori di m indica il numero di orbitali in un sottolivello con un particolare valore di l, ciascun valore di m si riferisce ad un differente orbitale.
Il numero totale dei valori di m coincide col numero totale di orbitali possibili per un dato valore di n.
Qundi assegnato [ n ] vi sono n2 orbitali e per un massimo 2n2 elettroni.
vale da -l a +l
S = SPIN = indica il verso di rotazione attorno al proprio asse dell’elettrone (che noi indichiamo con le frecce opposte). Deriva dall’equazione di Schrödinger
s = ½ o – ½
Quindi:

- Se ho un elettrone n = 3; l = 1; m = -1; s = 12 so che:
- N = 3 -> È nel terzo livello energetico
- L = 1 -> Si trova nell’orbitale p
- M = -1
- S = 12
Gli ORBITALI ISOENERGETCI O DEGENERI sono orbitali con elettroni di stessa energia (n ed l uguali)
In un orbitale s, p, d e f si trovano al massimo 2 elettroni
- Quanti elettroni ci sono al massimo in un orbitale s, p d ed f?
Nell’orbitale s ci sono al massimo 2 elettroni
Nell’orbitale p ci sono al massimo 6 elettroni (perché ci sono 3 orbitali p)
Nell’orbitale d ci sono al massimo 10 elettroni (perché ci sono 5 orbitali d)
Nell’orbitale f ci sono al massimo 14 elettroni (perché ci sono 7 orbitali f)
- Quanti elettroni si trovano in un certo livello energetico?
Basta applicare la formula 2n2 con “n” numero quantico principale
Es.: n = 1 -> 2 x (1)2 = 2
Per calcolare il numero di orbitali: n2
In un atomo di un elemento ci potrebbero essere vari livelli energetici (n) in cui ci potrebbero essere vari orbitali (l) ognuno orientati in modo diverso (m)
Esercizio 1
Quale delle seguenti affermazioni è vera ?
1)il numero quantico principale indica l’energia di un elettrone e la forma degli orbitali atomici
2) il numero quantico magnetico descrive l’orientamento degli orbitali nello spazio
3) il numero quantico magnetico dipende da L (numero quantico secondario)
- A Solo 1
- B Solo 2
- C Solo 3
- D Solo 1 e 2
- E Solo 2 e 3
Correzione commentata
La risposta corretta è la lettera E poiché la prima affermazione è falsa. Infatti il numero quantico principale indica l’energia e la dimensione degli orbitali, non la forma.
Esercizio 2
Qual è il numero quantico secondario di un elettrone contenuto in un orbitale 3p ?
- A 3
- B 2
- C 1
- D Da -3 a +3
- E Da 0 a 2
Correzione commentata
La risposta corretta è la lettera C. Il numero quantico secondario descrive la forma degli orbitali atomici. I valori di l sono interi e dipendono dal valore del numero quantico principale n. Ad ogni valore di l viene associata una delle lettere s, p, d ed f.
- l = 0 -> orbitale s (cioè sferico)
- l = 1 -> orbitale p (cioè bilobato simmetrico)
- l = 2 -> orbitale d
- l = 3 -> orbitale f