3.01 – Tavola Periodica
Storia della tavola periodica
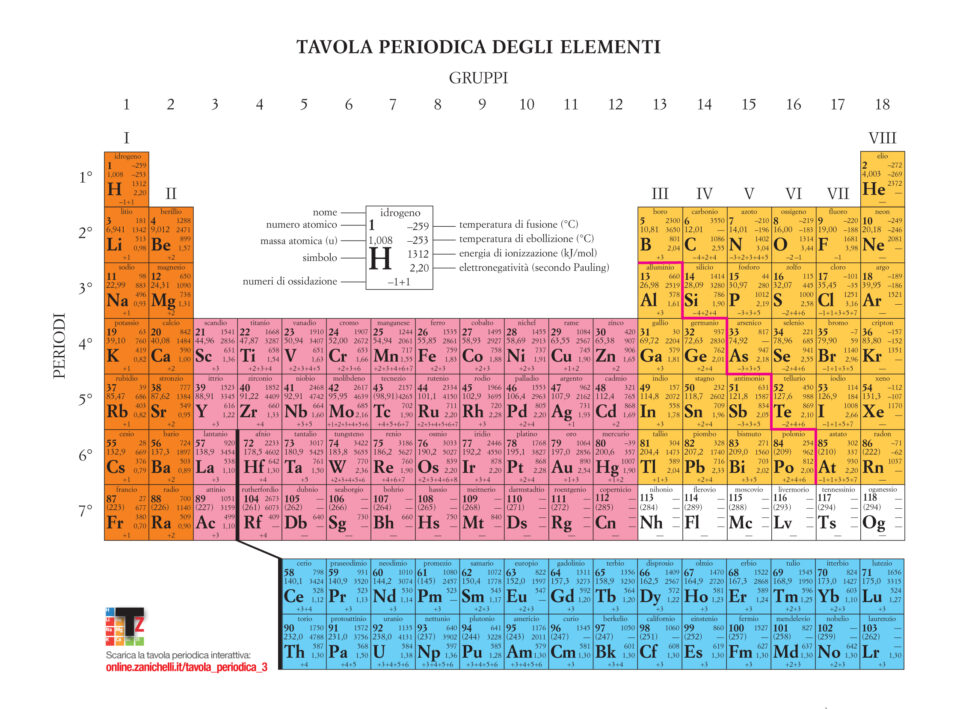
La tavola periodica degli elementi rappresenta uno degli strumenti più utili in chimica. La moderna tavola periodica deriva dal lavoro di Dmitri Mendeleev, un professore di chimica russo del diciannovesimo secolo. A quel tempo, gli scienziati avevan scoperto circa 65 elementi differenti e i chimici avevamo identificato molte delle loro proprietà, come le masse relative, la reattività ed alcune proprietà fisiche. Tuttavia, nessuno aveva ancora sviluppato un metodo sistematico per organizzarli.
Nel 1969 Mendeleev notò che alcuni gruppi di elementi presentavano proprietà simili. Trovò inoltre che se gli elementi venivano elencati in ordine di massa crescente, queste proprietà simili ricorrevano secondo uno schema periodico. Mendeleev riassunse queste osservazioni nella legge periodica: “quando gli elementi sono organizzati in ordine di massa crescente, alcune proprietà si ripetono periodicamente”. Mendeleev organizzò gli elementi noti in una tabella che consisteva in una serie di righe con massa crescente da sinistra verso destra. Sistemò le righe in modo tale che elementi con proprietà simili si trovassero nella stessa colonna verticale.
Formò dunque una tabella con
- 7 righe orizzontali chiamate periodi
- 18 righe verticali chiamati gruppi o famiglie. I gruppi generalmente sono classificati in A( elementi dei gruppi principali) e B (elementi di transizione).
Il fisico brittanico Henry Gwin Jeffreys Moseley notò delle incongruenze con la massa atomica per tale motivo decise di riordinare gli elementi non più secondo la loro massa bensì per il loro numero atomico (Z). Attualmente essa prende il nome di tavola periodica moderna e sono presenti dal 2016, grazie all’aggiunta di 4 nuovi elementi [ Nihonio (simboio Nh), Moscovio (Mc), Tennessinio (Ts) e Oganessio (Og) ], 118 eiementi.
Esercizio 1
Quale delle seguenti affermazioni è vera ?
- la tavola periodica attuale è organizzata con massa crescente
- la tavola periodica moderna è organizzata secondo il numero atomico
- ci sono 7 periodi (righe verticali) e 18 gruppi (righe orizzontali)
- A Solo 1
- B Solo 2
- C Solo 3
- D Solo 1 e 2
- E Solo 2 e 3
Correzione commentata
La risposta corretta è la lettera B. La prima affermazione è falsa in quanto la tavola periodica è organizzata con numero atomico crescente, non massa. L’ultima affermazione è falsa perché i gruppi sono le righe verticali e i periodi sono le righe orizzontali
Esercizio 2
Mendeleev organizzò la tavola periodica secondo ?
- A numero atomico crescente
- B numero di massa crescente
- C peso atomico
- D numero atomico decrescente
- E elettronegatività
Correzione commentata
La risposta corretta è la lettera B infatti Mendeleev organizzò la tavola periodica secondo numero di massa crescente. Nel 1969 Mendeleev notò che alcuni gruppi di elementi presentavano proprietà simili. Trovò inoltre che se gli elementi venivano elencati in ordine di massa crescente, queste proprietà simili ricorrevano secondo uno schema periodico. Mendeleev riassunse queste osservazioni nella legge periodica: “quando gli elementi sono organizzati in ordine di massa crescente, alcune proprietà si ripetono periodicamente”. Mendeleev organizzò gli elementi noti in una tabella che consisteva in una serie di righe con massa crescente da sinistra verso destra. Sistemò le righe in modo tale che elementi con proprietà simili si trovassero nella stessa colonna verticale.