3.03 – Proprietà della tavola periodica
Una volta comprese le configurazioni elettroniche, i chimici si resero conto che le somiglianze delle proprietà degli elementi sono la conseguenza della somiglianza delle configurazioni elettroniche del livello di valenza.
Gli elementi dello stesso gruppo e che dunque presentano uguale configurazione elettronica esterna, possiedono le stesse proprietà.
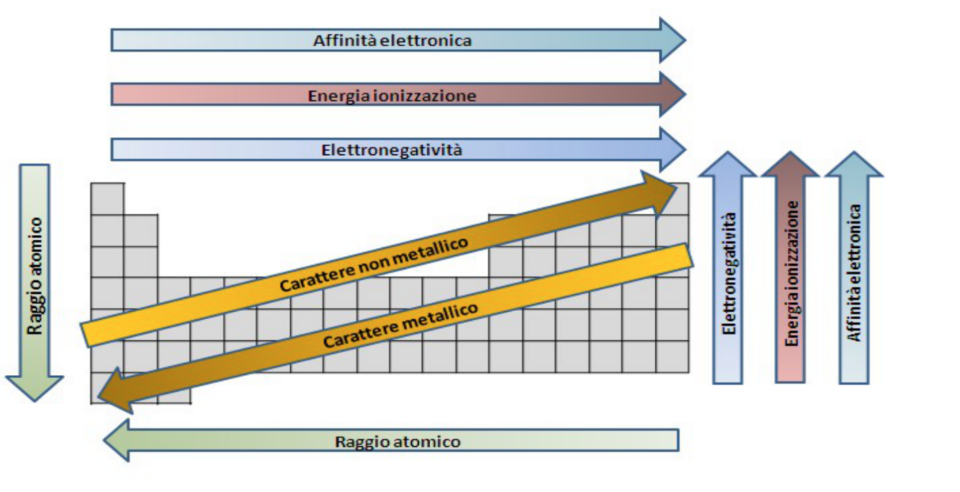
- L’affinità elettronica EA: è uguale in valore, ma di segno opposto, alla variazione di energia interna che si verifica quando un atomo in fase gassosa acquista un elettrone.Aumenta lungo il periodo da sinistra verso destra.Aumenta lungo il gruppo dal basso verso l’alto. è l’energia liberata da un atomo neutro quando acquista elettroni, in questo modo si ha la possibilità di avere un anione. La variazione di energia è misurabiie in kj/mole.
- L’energia di ionizzazione : L’energia di ionizzazione di un atomo o di una molecola è l’energia minima richiesta per allontanare un elettrone e portarlo a distanza infinita, allo zero assoluto, e in condizioni di energia cinetica nulla. Quindi l’energia necessaria per far avvenire il seguente processo: X(g) → X⁺ + e⁻ I₁ . Aumenta lungo il periodo da sinistra verso destra e aumenta lungo il gruppo dal basso verso l’alto. serve per “staccare” un elettrone dal livello di valenza ad un atomo neutro allo stato gassoso trasformandolo in catione. Esistono più livelli di energia di ionizzazione: il primo livello di ionizzazione è l’energia necessaria all’atomo per staccare un primo elettrone di valenza, il secondo è l’energia necessaria per staccare un secondo elettrone di valenza e così via con il terzo, quarto, quinto livello di ionizzazione… (es. Ca >primo livello> Ca+ > secondo livello > Ca++)

- L’elettronegatività : L’elettronegatività, simbolo χ, è una proprietà chimica che descrive la tendenza di un atomo ad attrarre verso di sé elettroni condivisi. Al livello più elementare, l’elettronegatività è determinata da fattori come la carica nucleare e il numero e posizione degli altri elettroni presenti nei vari orbitali atomici. Aumenta lungo il periodo da sinistra verso destra. Aumenta lungo il gruppo dal basso verso l’alto.
Per un maggiore approfondimento clicca questo messagio!
- Il raggio atomico: Il raggio atomico di un elemento è una misura delle dimensioni dei suoi atomi; è una grandezza difficilmente definibile in quanto in un atomo non esiste un confine netto. Aumenta lungo il periodo da destra verso sinistra. Aumenta lungo il gruppo dall’alto verso il basso. Ha questo andamento poiché avendo più elettroni e più livelli energetici avremo una maggiore distanza dai nucleo. Esso è definito anche come la metà della distanza internucleare tra due atomi di uno stesso elemento. L’unità di misura per calcolare il raggio atomico è in nanometri o in Angstrom.
- N.B. Il raggio atomico di un catione sarà minore dell’atomo neutro dello stesso elemento mentre il raggio atomico di un anione sarà maggiore dell’atomo neutro dello stesso elemento.

- Il carattere metallico: il carattere metallico è il nome dato all’insieme di proprietà chimiche associate agli elementi che sono metalli. Queste proprietà chimiche derivano dalla rapidità con cui i metalli perdono i loro elettroni per formare cationi (ioni caricati positivamente). Aumenta lungo il periodo da sinistra verso destra ed aumenta dall’alto. Aumenta lungo il gruppo dall’alto verso il basso.
Riassumendo:
Esercizio 1
Il candidato scarti la risposta falsa:
- A L’elettronegatività è la capacità, posseduta da un atomo che fa parte di una molecola, di attrarre gli elettroni dei legami covalenti in cui è coinvolto
- B L’elettronegatività riguarda la situazione dell’atomo non isolato
- C Un atomo con un’elevata elettronegatività attrae elettroni con grande forza, mentre uno con una bassa elettronegatività li attrae debolmente.
- D L’elettronegatività è una proprietà di tutti gli elementi della tavola periodica
- E L’elettronegatività è determinata da fattori come la carica nucleare e il numero e posizione degli altri elettroni presenti nei vari orbitali atomici
Correzione commentata
D. La risposta da scartare è la lettera D: L’elettronegatività è una proprietà di tutti gli elementi della tavola periodica. E’ infatti sbagliato poiché i gas nobili non possiedono elettronegatività
Esercizio 2
Il candidato scarti la risposta errata:
- A L’energia di ionizzazione di un atomo o di una molecola è l’energia minima richiesta per allontanare un elettrone e portarlo a distanza infinita
- B L’energia di ionizzazione è l’energia necessaria per far avvenire il seguente processo: X(g) → X⁺ + e⁻ I
- C L’energia di ioniozzazione si misura in kilojoule per mole (kJ/mol)
- D l’energia di ionizzazione è una misura della difficoltà di rimozione di un elettrone
- E nessuna delle precedenti
Correzione commentata
E. La risposta corretta è la lettera E, nessuna delle precedenti.