6.01 – Trasformazioni chimiche
Una reazione chimica è un processo in cui alcune sostanze (reagenti) si trasformano in altre (prodotti), ciò avviene grazie alla rottura di legami chimici e alla formazione di nuovi.
Nel processo sono coinvolti soltanto gli elettroni degli strati più esterni.
Le reazioni possono essere suddivise in due grandi categorie:
- Reazioni redox, in cui varia il numero di ossidazione nei reagenti e nei prodotti.
- Reazioni non redox, in cui non c’è variazione del numero di ossidazione.
Esiste un altro modo per classificare le reazioni che descrive meglio il processo chimico:
- Reazioni di neutralizzazione: avvengono tra un acido e una base e sono anche dette di salificazione o acido-base.
Es: HBr+KOH -> KBr+H2O
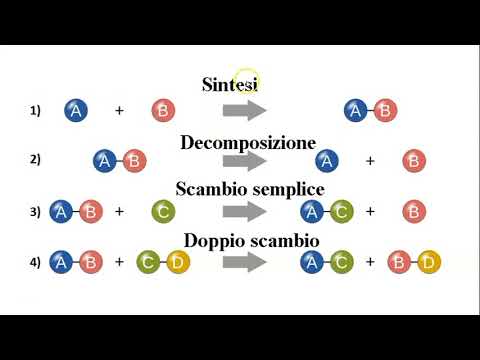
- Reazioni di doppio scambio: avvengono quando gli ioni che compongono i reagenti si scambiano e si forma un precipitato (prodotto poco solubile).
Es: CaCO3 + 2HCl -> CaCl2 + CO2 + H2O
- Reazioni di sintesi: avvengono quando due reagenti allo stato elementare formano un composto (prodotto).
Es: 2H2+O2->2H2O
- Reazioni di idrolisi: avvengono quando un reagente viene scisso in due composti da una molecola d’acqua.
Es: NaCl+ H2O->Na++Cl–
- Reazioni di disidratazione: avvengono quando si sottrae acqua ai reagenti.
Es: H3PO4 →HPO3+H2O
- Reazioni di addizione: avvengono quando da due reagenti si forma un unico prodotto.
Es: CO2+H2O→H2CO3
- Reazioni di decomposizione: avvengono quando il reagente si trasforma in prodotti più semplici.
Es: 2NH3→3H2+N2
Bilanciamento di reazioni chimiche
In tutte le trasformazioni chimiche deve essere rispettata la legge di conservazione della massa formulata da Lavoisier: “in una reazione chimica, la somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti.”
Da questa legge nasce la necessità di bilanciare la reazione con i coefficienti stechiometrici, attraverso i quali la somma degli atomi di ciascun elemento deve risultare uguale sia nei reagenti che nei prodotti.
È importante precisare che i rapporti tra reagenti e prodotti definiti dai coefficienti stechiometrici sono espressi in moli e non in grammi.
Per poter bilanciare una reazione è necessario seguire un ordine preciso: prima si bilanciano gli atomi dei metalli e dei non metalli e in seguito quelli di ossigeno e di idrogeno; è fondamentale, inoltre, ricordare che NON si possono modificare i pedici delle formule, che indicano la composizione dei composti.
In seguito al bilanciamento, è possibile calcolare le quantità dei prodotti che si formano conoscendo quella dei reagenti e viceversa ma è importante considerare dei fattori che possono cambiare i calcoli stechiometrici come l’equilibrio di reazione e il reagente limitante.
Il primo influenza la reazione perché, se essa non giunge a completezza, si stabilisce uno stato di equilibrio in cui le concentrazioni dei reagenti e dei prodotti non variano più nel tempo mentre il secondo è fondamentale in quanto, essendo in quantità stechiometrica minore, limita la formazione di prodotti.
Esempi di bilanciamento:
H3PO4+3NaOH→Na3PO4+3H2O
Na2CO3+2HNO3→2NaNO3+CO2+H2O
