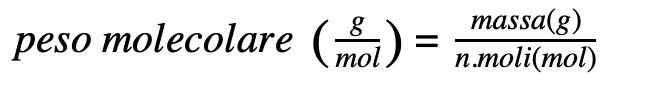6.02 – Stechiometria di base
Le sostanze si presentano in diverse forme e stati e possono appartenere ad una di queste due categorie:
- Elemento: sostanza pura costituita da un unico tipo di atomo; ad ogni elemento compete un simbolo.
- Composto: sostanza pura costituita da due o più tipi di atomo; ad ogni composto compete una formula.
Esiste, inoltre, una differenza tra la formula e la molecola:
- Formula: abbiamo più di un modo per scrivere la formula di un composto:
– formula molecolare: descrive la composizione delle molecole del composto. Ad esempio per l’etanolo indica che in ogni molecola ci sono 2 atomi di carbonio, 6 atomi di Idrogeno e 1 atomo di ossigeno. Non fornisce informazioni sulla struttura
– formula estesa: mette in evidenza come certi atomi siano legati tra loro. Ad esempio la formula estesa dell’etanolo CH3CH2OH ci dice che la molecola è costituita da 3 gruppi: un gruppo OH, un gruppo CH2 e un gruppo CH3.
– formula di struttura: fornisce informazioni strutturali più dettagliate, in quanto mostra come gli atomi siano legati tra loro nella molecola.
Molecola: è la più piccola parte di sostanza (elemento/ composto), che manifesta tutte le sue proprietà ed è, perciò, isolabile; essa è in genere costituita da due o più atomi, che possono essere uguali o diversi. (HCl, HF, H2O…)
Questa differenza è molto importante per definire i diversi tipi di pesi ma prima di introdurli, è necessario menzionare l’unità di massa atomica ossia 1/12 dell’atomo di Carbonio-12.
Il peso atomico (PA) è riferito alle sostanze allo stato elementare e indica quante volte l’elemento è più pesante rispetto all’unita di massa atomica mentre per le sostanze molecolari utilizziamo il peso molecolare (PM) e per quelle ioniche il peso formula (PF).
Il peso molecolare e formula si ottengono sommando i vari pesi molecolari degli atomi che compongono la molecola o il composto ionico.
Mole
La mole è una delle sette grandezze fondamentali del Sistema Internazionale ed è la misura della quantità di sostanza.
Essa è definita come la quantità di sostanza che contiene tante entità elementari, atomi o molecole, quanti sono gli atomi di carbonio in 12 grammi di Carbonio-12. Una mole è dunque uguale a 6.022×10^23 particelle
La mole è calcolata come il rapporto tra la massa espressa in grammi e il peso molecolare.
n=m(grammi)/PM
Numero di Avogadro
Risulta impossibile pesare una singola particella e studiarne il suo comportamento chimico-fisico. Per questo motivo si prendono in considerazione un gran numero di particelle, definito come Numero di Avogadro. Esso corrisponde al numero di particelle elementari, atomi o molecole, presenti in una mole di sostanza. È, inoltre, il reciproco dell’unità di massa misurata in grammi e di conseguenza esprime anche quante u.m.a. sono contenute in un grammo di sostanza. Esso è uguale a 6,022x10^23= 11,66×10-24g/uma. Questa definizione nasce da un’osservazione di Avogadro sul comportamento dei gas ideali, egli notò che volumi uguali di gas diversi, misurati nelle stesse condizioni di temperatura e pressione, contengono lo stesso numero di molecole.
Esempi:
- Una mole di atomi di He corrisponde a 6,022×1023 atomi.
- Una mole di atomi di Cl2corrisponde a 2×6,022x1023atomi. (Moltiplichiamo per due perché la molecola è biatomica)
FORMULE INVERSE MOLI
Come convertire le moli in grammi?
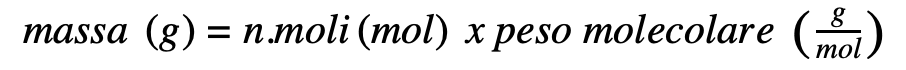
E come ottenere il peso molecolare?