9.02 – Equilibri
Consideriamo la reazione:
αA + βB -> δC + γD
La reazione considerata è una reazione chimica che avviene in modo completo in quanto al termine di questa avremo che i reagenti vengono trasformati completamente in prodotti. Queste reazioni vengono scritte con una freccia.
Consideriamo ora la reazione:
αA + βB <-> δC + γD
Osserviamo come la reazione è caratterizzata da una doppia freccia. La doppia freccia indica una reazione reversibile in quanto contemporanemanete avremo la formazione dei prodotti i quali potranno reagire tra di loro al fine di riformare i reagenti.
Quando inizia la reazione, la velocità dei reagenti sarà massima per poi dimunire in quanto avremo un consumo di reagenti per formare i prodtti.
A mano a mano che si ha la formazione dei prdotti , la velocità di questi aumenta fino a diminuire fin quando non riavremo la formazione dei reagenti vale a dire la reazione inversa.
Dopo un determinato tempo avremo che la reazioen è in equilibrio.
Cosa significa che una reazione è in equilibrio?
Una reazione è in equilibrio quando la velcotià della reazione diretta e la velocià della reazione inversa sono uguali.
Vdiretta=Vinversa
Nota bene:
É importante comprendere bene questa definizione e NON considerare l’equilibrio come una fase di arresto della reazione ma, ripetiamo, una fase in cui la velocità dei reagenti sarà uguale alla velocità dei prodotti.
Macroscopicamente non avremo cambiamenti ma microscopicamente le reazioni avverranno con la stessa velocità per questo motivo possiamo parlare di equilibrio dinamico.
Avremo che Vd=Kd [A]α*[B]β mentre Vi=Ki [C]δ*[D]γ
Eseguendo dunque un rapporto tra le due costanti avremo
Keq = ( [C]δ*[D]γ ) / ( [A]α*[B]β )
Sappiamo che un rapporto tra due costanti è una costante, in questo caso , la costante di equilibrio Keq.
- Se Keq è molto grande, il rapporto tra prodotti e reagenti è a favore dei prodotti.
- Se Keq è molto piccola, il rapporto è a favore dei reagenti.
- Se Keq è uguale a 1, la concentrazione dei reagenti e dei prodotti sono uguali.
Equilibri in fase gassosa:
Se consideriamo una miscela gassosa la quantità dei reagenti e la quantità dei prodotti sono indicate non più con la molarità ma con la pressione parziale. Andremo, quindi, a considerare la costante intesa come Kp.
Sussiste una relazione tra kp e kc ricavabile dall’equazione dei gas perfetti, vale a dire:
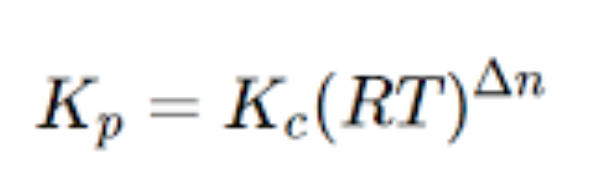
- R -> Costante dei gas perfetti
- T -> temperatura
- Δn -> rappresenta la differenza tra la somma dei coefficienti stechiometrici
Se Δn > 0 -> Kp > kc
Se Δn < 0 -> kp < kc