Cinetica chimica
La cinetica chimica è la branca della chimica che studia la velocità di reazione ed il meccanismo con cui avvengono.
- La cinetica pone come punto di partenza dei sui studi una teoria, la teoria degli urti.
- Secondo questa teoria affinchè due o più reagenti possano rompere dei legami per formarne dei nuovi e diventare prodotti l’urto deve essere ufficace vale a dire deve avvenire con la giusta forza e con la giusta orentazione.
- Gli urti affinchè dunque determinano la fomazione di prodotti a partire dai reagenti è necessario che questi si urtino con una forza cinetica minima.
- Secondo questa teoria affinchè due o più reagenti possano rompere dei legami per formarne dei nuovi e diventare prodotti l’urto deve essere ufficace vale a dire deve avvenire con la giusta forza e con la giusta orentazione.
- L’energia cinetica minima o energia di attivazione è l’energia minima necessaria affinchè abbia inizio una reazione.
- Possiamo immaginarla come una barriera da superare, il cui valore minimo è di circa 80 kJ/mol, al fine di iniziare una reazione.
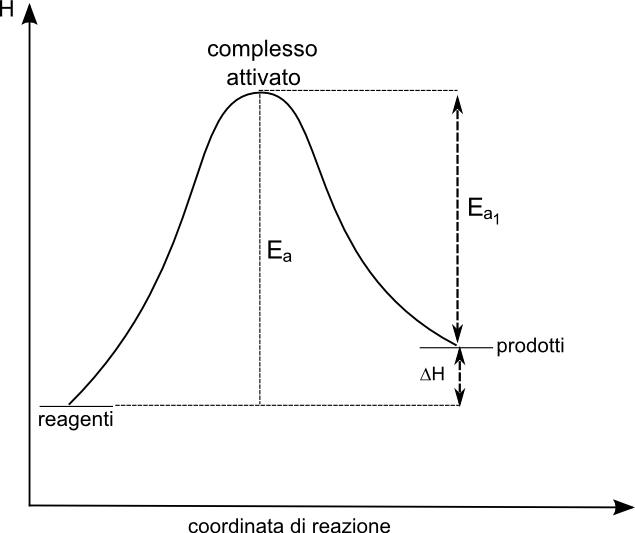
- Lo stato energitico raggiunto dalle molecole dopo un urto è detto stato di transizione o complesso attivato.
- Il complesso attivato non è un intermedio di reazione per tale motivo non è isolabile
- Che cos’è la velcotià di reazione?
- Essa viene definita come “la variazione della quantità di un reagente, o di un prodotto, nell’unità di tempo.”
- Come si misura?
- Considerando la reazione αA + βB -> γC + δD
- Come si misura?
- Essa viene definita come “la variazione della quantità di un reagente, o di un prodotto, nell’unità di tempo.”
- In chimica, la velocità è data dalla variazione della concentrazione di A in funzione del tempo
- v= – Δ[A]/ΔT
- Se consideriamo la velpcità dei prodotti non consideriamo il – quindi avremo:
- v= -Δ[C]/ΔT
Mettendoci sempre nelle stesse condizioni di temperatura e pressione possiamo considerare la generica formula:
v= K [A]m * [B]n
dove i valoi di m e n non corrispondono ai coefficienti stechiometrici tuattabia sono determinati sperimentalmente.
Grazie ai valori di m ed n possiamo definire l’ordine di reazione.
Reazione di ordine zero
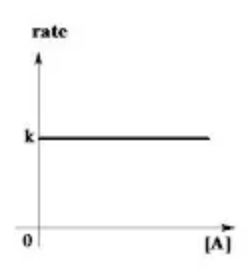
Nelle reazioni di ordine 0 è importante sottolineare che la concentrazione dei reagenti non influisce sulla velocità di reazione!
In questo caso avremo quindi v=k
Reazione di primo ordine
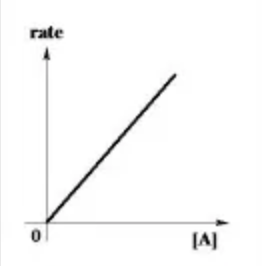
In queste reazioni la velocità di reazione è influenzata dalla concentrazione di un solo reagente.
Un esempio tipico sono i decadimenti radiattivi.
Reazione di secondo ordine
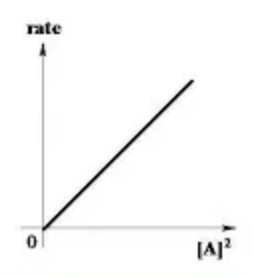
In queste reazioni la velocità di reazione è influenzata dalla concentrazioni di entrambi i reagenti!
Avremo quindi v=[A]2
La velocità di scomparsa del reagente diminuisce con il quadrato della sua concentrazione residua.
Che cosa influenza la velocità di una reazione?
Tra i fattori che influenzano la velocità di reazione abbiamo:
- La presenza dei catalizzatori
- La temperatura
- La natura dei reagenti
- La concentrazione dei reagenti
- La superficie di contatto
Aumentare la temperatura significa aumentare anche l’energia cinetica delle particelle per tanto avremo una maggiore collisione tra le particelle.
Questo situazione è descritta dall’Equazione di Arrhenius la quale è direttamente proporzionale alla temperatura e inversamente proporzionale all’energia di attivazione.
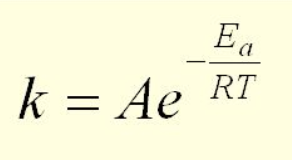
La cinetica studia anche il tempo di trasformazione o emivita vale a dire il tempo necessario per dimezzare la concentrazione di un reagente. L’emivita è necessario anche per determinare il regime posologico.