10.01 – Basi di chimica organica
La chimica organica è quella disciplina che si occupa di studiare le principali combinazioni del carbonio con alcuni elementi, come per esempio l’idrogeno, lo zolfo, l’ossigeno, il fosforo, gli alogeni. Si dà anche una certa attenzione agli idrocarburi, agli alcheni, agli alchini e agli areni. Una classificazione generale dei composti organici si fonda sulla natura degli atomi che li costituiscono, suddividendoli in Idrocarburi ed Eterocomposti. Gli Idrocarburi sono composti organici contenenti solo Carbonio (C) e Idrogeno (H)· Gli Eterocomposti contengono anche altri atomi (eteroatomi) oltre a C e H, in particolare Ossigeno (O), Azoto (N), Zolfo (S) e Fosforo (P). Una ulteriore classificazione si fonda sulla forma della molecola, suddividendo i composti organici in aciclici e ciclici. Si definiscono aciclici i composti organici a catena aperta di atomi di carbonio, lineare o ramificata. Si definiscono ciclici i composti organici a catena chiusa in uno o più anelli (monociclici e policiclici). Un’ultima classificazione suddivide i composti organici in alifatici ed aromatici. Si definiscono aromatici i composti organici ciclici che presentano almeno un anello di tipo benzenico, con più doppi legami che costituiscono una nuvola di elettroni π delocalizzata sull’intero anello. Si definiscono alifatici i composti organici ciclici ed aciclici non aromatici (il termine ‘alifatico’ si riferisce propriamente solo agli idrocarburi non aromatici).
Dunque si definisce composto organico dunque un qualsiasi composto del carbonio che, almeno in origine, sia stato sintetizzato da un essere vivente (Es.: insulina e urea). Questi contengono sempre idrogeno e carbonio, spesso ossigeno e azoto, più raramente invece contengono zolfo, alogeni e fosforo. Possono essere riuniti in classi ciascuna con proprietà chimico-fisiche caratteristiche
Il carbonio può dare tanti composti organici vari perché ha una particolare natura
Il carbonio è unico tra gli elementi della tavola periodica. Ha molta tendenza alla concatenazione cioè il carbonio si lega con altri atomi di carbonio formando catene aperte (possono essere lineari o ramificate) o catene chiuse ad anello. Presenta una configurazione elettronica esterna 2s2 2p2 (quindi appartiene al 4 gruppo e ha 4 elettroni nel livello esterno). Ha un valore intermedio di elettronegatività cioè è tale che può legarsi covalentemente con tutti i non metalli e con quasi tutti i metalli. Grazie alla posizione centrale nella tavola periodica e al valore di elettronegatività tende a raggiungere l’ottetto condividendo elettroni e formando nuovi legami con altri atomi. Può essere ibridato a sp3, sp2 o sp quindi di ha:
Ibridazione sp3 -> quando il carbonio è legato a 4 atomi e i 4 orbitali sp3 liberi sono orientati verso i vertici di un tetraedro con angoli di 109,5°
Ibridazione sp2 -> quando il carbonio è legato a 3 atomi e i 3 orbitali sp2 liberi sono orientati verso i vertici del triangolo equilatero con angoli di 120°
Ibridazione sp -> quando il carbonio è legato a 2 atomi e i 2 orbitali sp liberi sono disposti lungo una retta passante per il nucleo dell’atomo
Possono formare legami covalenti singoli, doppi o tripli grazie alla presenza di 4 elettroni nello strato di valenza:
Legami semplici -> C – C (sp3)
Legami doppi -> C = C (sp2)
Legami tripli -> C ≡ C (sp)
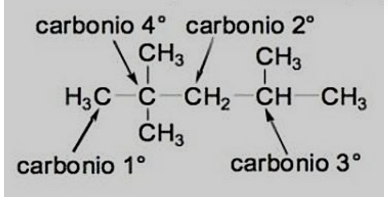
Nei composti organici gli atomi di carbonio sono sempre ibridati e formano sempre 4 legami covalenti. Un atomo di carbonio può essere classificato in base al numero di atomi di carbonio a esso legati:
Atomo di carbonio primario (1°) -> legato a un solo altro atomo di carbonio
Atomo di carbonio secondario (2°) -> legato a 2 altri atomi di carbonio
Atomo di carbonio terziario (3°) -> legato a 3 atomi di carbonio
Atomo di carbonio quaternario (4°) -> legato a 4 atomi di carbonio
NOMENCLATURA DEI COMPOSTI ORGANICI
- I composti organici sono denominati in base alle regole della nomenclatura IUPAC; con queste regole posso attribuire un nome ad ogni composto organico e posso riconoscerlo anche senza sapere la sua formula di struttura del composto organico
- Molti composti hanno un “nome d’uso o nome comune” (non permette di risalire alle formule di struttura) che non deriva dalla nomenclatura IUPAC perché sono stati scoperti prima della nascita dalla nomenclatura IUPAC
- Il nome di un composto organico con la nomenclatura IUPAC è composto da 3 parti che vanno messe in questo ordine cioè desinenza -> radice -> prefisso:
- La desinenza: indica la classe di composti organici in cui il composto appartiene
- La radice: indica il numero di atomi di carbonio nella catena più lunga (quella principale), che è possibile individuare nel composto
- Il prefisso: indica la posizione della catena principale dei vari sostituenti e/o gruppi funzionali
GRUPPI FUNZIONALI
È un atomo o un gruppo di atomi legati al carbonio, diversi dall’idrogeno. Legato alla catena di carboni è responsabile delle proprietà chimico-fisiche del composto e da una certa reattività alla molecola di cui fa parte. I composti che hanno lo stesso gruppo funzionale presentano le stesse proprietà chimico-fisiche e quindi possono essere raggruppati nella stessa classe. Invece le molecole che hanno lo stesso gruppo funzionale costituisco una classe di composti
C =C – CH2 – CH2 -> si chiama gruppo funzionale e il resto della catena si chiama scheletro molecolare
In base al numero di gruppi funzionali presenti nella molecola, i composti organici si dividono in:
- Monofunzionali -> contengono solo un gruppo funzionale
- Polifunzionali -> contengono 2 o più gruppi funzionali che possono essere uguali o diversi
| Gruppo funzionale | Nome | Classe | Formula generale | Desinenza |
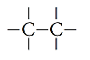 | Legame semplice | Alcani | CnH2n+2 | -ano |
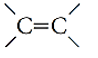 | Doppio legame | Alcheni | CnH2n | -ene |
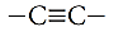 | Triplo legame | Alchini | CnH2n-2 | -ino |
| -X (= generico alogeno) | Alogeno | Alogenuri alchilici | ||
| -OH | Gruppo ossidrilico | Alcoli | R-OH (= generico gruppo alchilico) | -olo |
| -O- | Gruppo estere | Eteri | R-O-R’ | -etere |
| R CHO R-CO-R’ | Gruppo carbossilico | Aldeidi Chetoni | -CHO C=O | -ale -one |
| COOH | Gruppo carbossilico | Acidi carbossilici | carbonile ed ossidrile | -oico |
| RCOOR | Gruppo estere | Esteri | -ato di -ile | |
| Alogeno | Alogenuri alchilici | R-X | ||
| RCONH2 | Gruppo ammidico | Ammidi | -ammide | |
| -NH2 | Gruppo amminico | Ammine (primarie) | R-NH2 | |
| -C≡N | Ciano o nitrile | Nitrili | R-C≡N | |
| -NO2 | Gruppo nitro | Nitroderivati | R-NO2 | |
| -SH | Gruppo tiolico | Tioli o mercaptani | R-SH |
REATTIVITÀ DEI COMPOSTI ORGANICI
La reattività è la capacità a trasformarsi di un qualunque composto per azione di un reagente. Questa dipende dalle condizioni di reazione, dal tipo legame che deve essere rotto o dal tipo di legame che deve essere formato. Per capire la reattività dei composti organici bisogna analizzare la molecola considerando i gruppi funzionali come centri di reazione in cui sono legati i vari sostituenti. La natura del centro di reazione determina il tipo di reazione, la natura dei sostituenti e la reattività. Nella maggior parte delle reazioni sulla molecola che reagisce si sviluppa una carica positiva o negativa; se questa carica è un atomo di carbonio viene chiamato carbonatine o di carbanione
Si formano quando si ha una rottura elettronica del legame covalente, in cui uno dei 2 atomi trattiene il doppietto elettronico e l’altro ne resta senza il doppietto elettronico
Un atomo di carbonio con un elettrone spaiato viene chiamato radicale libero. Questo si può originare in seguito a una rottura omolitica del legame covante, nella quale ciascuno dei 2 atomi originariamente legati mantiene uno dei 2 elettroni di legame (rottura omolitica)
REAGENTI ELETTROFILI E NUCLEOFILI
Nelle reazioni organici i reagenti vengono divisi in 2 categorie:
- Reagenti elettrofili o acidi di Lewis: sostanze con una lacuna elettronica o una carica positiva totale o parziale. Sono detti elettrofili perché reagiscono con atomi o molecole ricche di elettroni (si chiamano nucleofili) (Es.: H+, BCl3 e l’atomo C nel gruppo carbonilico: -CO)
- Reagenti nucleofili o basi di Lewis: sostanze in grado di fornire elettroni perché sono dotate di carica negativa (può essere totale o parziale) o di almeno un doppietto elettronico solitario. Sono detti nucleofili perché reagiscono con gli atomi e le sostanze prive di elettroni (sono detti elettrofili) (Es.: OH–, CN– e l’atomo di N nel gruppo amminico: -NH2)